GI医声第2期 I 靶向创新疗法助力消化道肿瘤精准治疗,引领治疗前沿
医脉通 2023.09.13

GI 医声
13条内容

导读: 消化道肿瘤是全球面临的重大健康问题,其中中国患者结直肠癌、胃癌、食管癌的发病率居全球前列。近年来,以靶向治疗为代表的精准治疗快速进步,成为肿瘤治疗领域的“明星”利器,在消化道肿瘤领域打开新局面。为此,本期GI医声特邀西京医院卢瑗瑗教授、江苏省肿瘤医院李晟教授、中山大学肿瘤防治中心王志强教授分享消化道肿瘤靶向治疗进展,以飨读者。

研究背景
难治性mCRC患者从目前的以化疗为基础标准治疗中获益有限,亟需有效的治疗方案。针对特定分子标志物的靶向治疗可提升治疗效果。HER2阳性作为mCRC的可成药靶点之一,尽管在所有mCRC患者中的发生率为3%~5%,但在RAS野生型mCRC患者中却高达10%。Tucatinib是一种高选择性、靶向HER2的酪氨酸激酶抑制剂。MOUNTAINEER试验旨在评估Tucatinib和曲妥珠单抗联合治疗HER2阳性 mCRC患者的有效性和安全性。
研究设计
MOUNTAINEER研究是一项全球性、开放标签、随机II期临床试验,纳入既往接受过治疗的HER2扩增RAS野生型难治性mCRC患者。研究初期为单队列设计,患者接受Tucatinib(300mg,PO,BID)联合曲妥珠单抗(初始负荷剂量8mg/kg IV,后续每3周6mg/kg IV)治疗直至疾病进展(队列A)。在中期分析后,研究队列扩展为患者按照4:3被随机分配至Tucatinib联合曲妥珠单抗(队列B)或Tucatinib单药(队列C)治疗。研究的主要终点为队列A+B经盲法独立中心评审(BICR)的确认客观缓解率(ORR)。
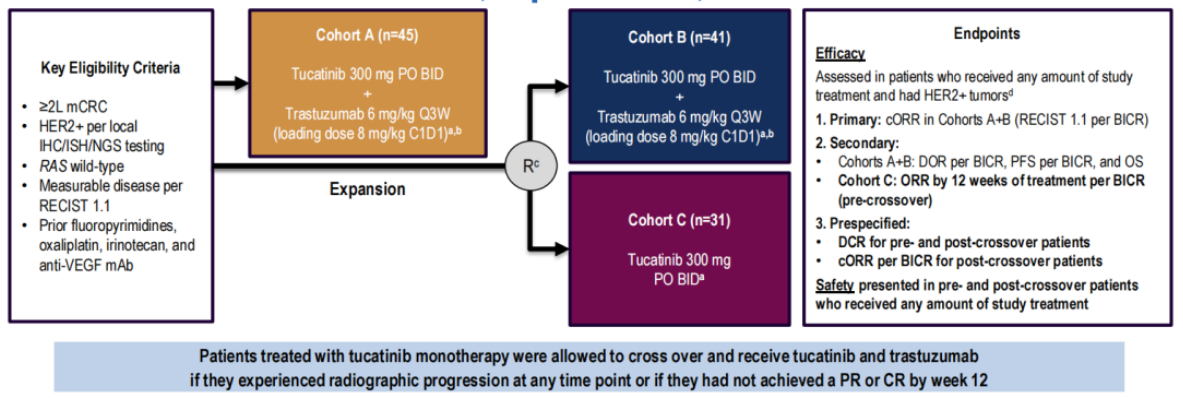
图1 研究设计
研究结果
疗效数据
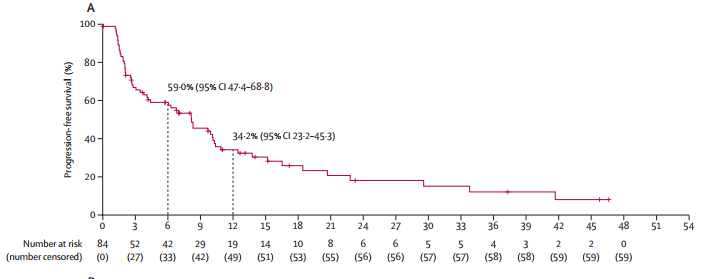
图2 队列A+B经BICR评估的PFS
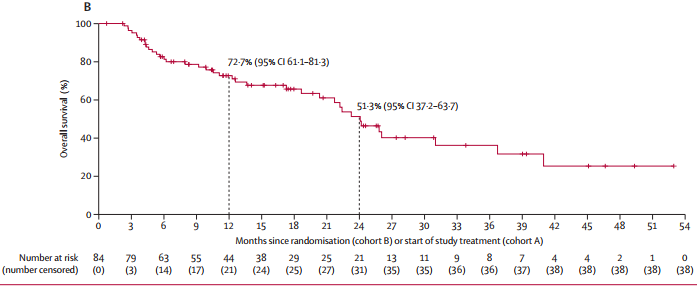
图3 队列A+B经BICR评估的OS
安全性数据
研究结论
对于化疗难治性HER2阳性、RAS野生型mCRC患者,曲妥珠单抗联合tucatinib的疗效显著且安全性可控,可显著改善此类患者的生存获益,Tucatinib联合曲妥珠单抗有望成为HER2阳性mCRC患者新的标准治疗方案。
专家锐评

在先前的临床研究中,单独使用抗HER2单药治疗在HER2阳性mCRC患者中的抗肿瘤活性较低,因此关于单药治疗的文献较少,仅限于个案报道。曲妥珠单抗问世之后,多项研究对其单药及联合化疗在HER2阳性mCRC患者中的应用进行了评估,但结果均不尽人意。之后,双靶联合治疗改变了这一现状。以曲妥珠单抗为基础的双靶HER2抑制方案已得到广泛应用,ORR约为10%~32%。临床前研究显示,Tucatinib与曲妥珠单抗联合使用可能在抑制HER2信号传导、刺激免疫应答方面产生互补效应。MOUNTAINEER研究的ORR高达38.1%,优于以往研究结果。
基于MOUNTAINEER研究数据,2023年1月19日,Tucatinib联合曲妥珠单抗被FDA批准用于RAS野生型、HER2阳性、不可切除的mCRC患者的二线治疗,成为首个获FDA批准专门针对HER2阳性结直肠癌的疗法。MOUNTAINEER研究是迄今为止最大的前瞻性研究,评估去化疗的双靶治疗方案在HER2阳性不可切除mCRC患者中的应用。结果显示,Tucatinib联合曲妥珠单抗在化疗难治的HER2阳性和RAS野生型不可切除mCRC患者中表现出良好抗肿瘤活性,且安全性可耐受,不影响患者的生活质量。超过一半的患者在疾病进展后仍接受了后续抗癌治疗,提示患者在治疗期间身体状况和生活质量良好。
尽管HER2阳性已成为mCRC的可治疗靶点,但对于HER2扩增/过表达的检测仍然被低估,已有多种检测方法成功用于识别HER2阳性,并且其中一些方法在MOUNTAINEER研究中得到了应用,进一步支持HER2靶向治疗在HER2阳性mCRC患者中的使用。然而,MOUNTAINEER研究也存在局限性,该研究为开放标签设计,缺乏严谨的头对头比较。目前,全球性随机III期确证性研究MOUNTAINEER-03正在进行中,以进一步验证曲妥珠单抗联合tucatinib的疗效和安全性。

研究背景
维持血管生成抑制和转换化疗方案是目前RAS突变型mCRC患者的主要二线治疗方法。且III期ML18147和VELOUR研究提示,一线治疗后维持血管生成抑制对mCRC患者有益,可为RAS突变型mCRC患者提供新的二线治疗选择。瑞戈非尼是一种针对血管生成、肿瘤生成的口服多激酶抑制剂,已经在III期研究中展现出对化疗耐药患者的生存获益以及可接受的安全性,有望成为RAS突变型mCRC患者的一种合适的二线治疗方法。2023年ESMO OPEN在线发表了评估瑞戈非尼单药作为RAS突变型mCRC二线治疗的STREAM研究结果。
研究设计
STREAM是一项学术性、多中心、单臂II期研究,根据研究入组6个月后无进展的患者比例(6mo-PF)评价瑞戈非尼治疗RAS突变型mCRC的效果。入组的RAS突变型mCRC患者接受氟尿嘧啶、奥沙利铂和贝伐珠单抗预处理治疗。根据Simon两阶段设计,主要终点为总人群(n=46)中需要≥18例患者达到6mo-PF。研究次要终点为安全性、客观缓解率(ORR)、无进展生存期(PFS)和总生存期(OS)。
研究结果
ORR、PFS、OS数据
总人群ORR为10.9%,疾病控制率(DCR)为54.6%,中位PFS为3.6个月(95%CI:1.9-6.7个月),中位OS为18.9个月(95%CI:10.3-35.3个月),中位PFS2(从入组至三线治疗进展)为13.3个月(95%CI:8.4-19.7个月)。
长期获益者的临床特征
14例达到6mo-PF的患者为长期获益者,根据基线特征,长期获益者多为单一转移部位和肺限制性疾病,这部分患者的中位PFS(10.2个月 vs 1.9个月)、中位OS(38.8个月 vs 13.4个月)均优于治疗不足6个月的不良获益者。
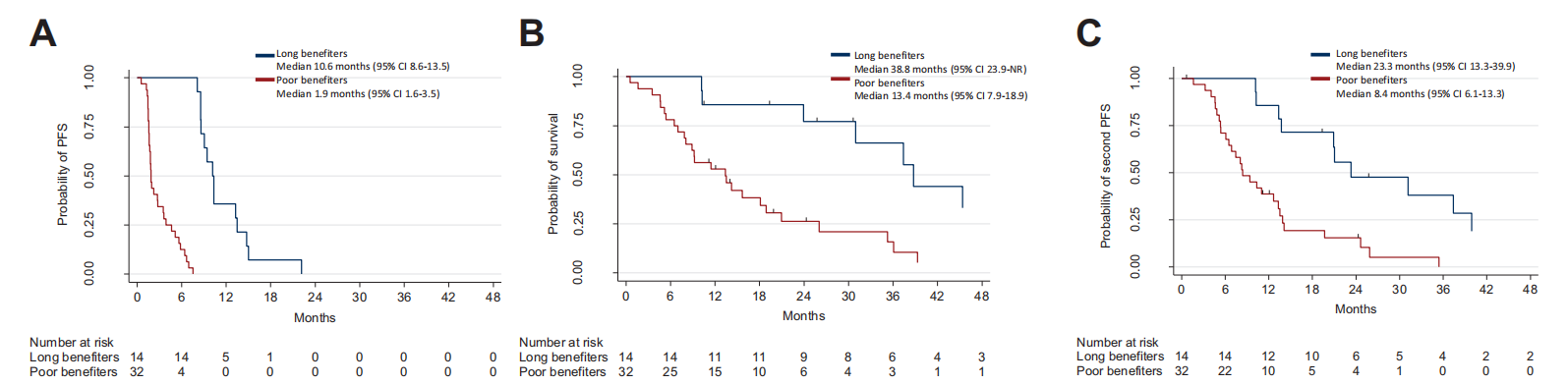
图1. 接受瑞戈非尼治疗的长期获益者和不良获益者的KM曲线
安全性数据
43例(91.5%)患者至少发生了一种任意级别的治疗相关不良事件(TRAE),18例(38.3%)患者发生了3级及以上TRAE,其中大部分为手足综合征(12.8%)、疲劳(6.4%)和高胆红素血症(6.4%)等。未发现新的安全性信号。
表1. STREAM研究结果汇总
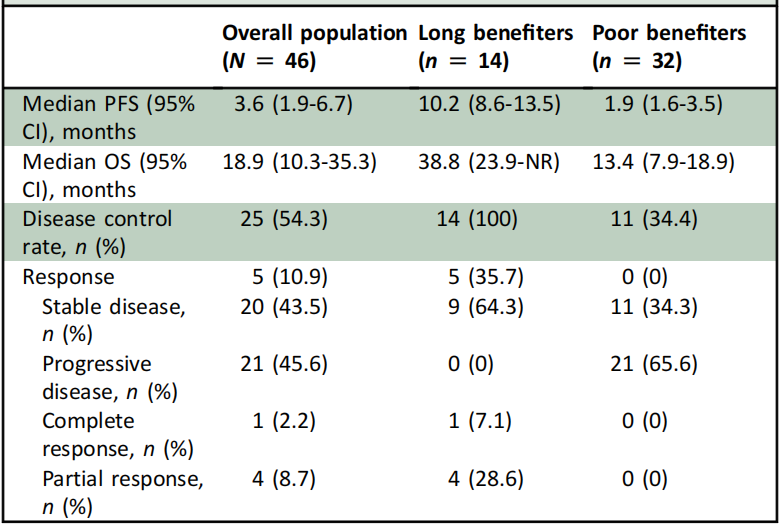
研究结论
尽管STREAM研究未达到主要研究终点,但瑞戈非尼的耐受性良好,不影响后续治疗。而且具有良好预后特征(单一转移部位和肺限制性疾病)的患者经瑞戈非尼治疗获得了良好获益。在经选择的具有有利临床特征的患者组中,瑞戈非尼无化疗间期与持久疾病控制相关。
专家锐评

一直以来,RAS突变型mCRC患者存在治疗选择有限且预后不良的挑战。STREAM研究为这部分患者的治疗提供了思路,尽管中位PFS较短,但OS获益令人惊喜,为18.9个月,甚至好于VEGF单抗跨线的ML18147和VELOUR总生存结果。研究还显示瑞戈非尼二线治疗不影响后续治疗效果。总体而言,STREAM研究中有37例(80.4%)患者接受了三线治疗,中位PFS2为13.3个月,疗效良好。
此外,一如既往研究中所报告的结果,无论是否接受瑞戈非尼治疗,获益有限患者的整体预后较差,在所有治疗线中均与不良预后相关。事实上,在一线化疗期间发生早期进展的mCRC患者在二线治疗中均表现出较差的临床结局,与是否使用抗血管生成药物无关。值得注意的是,无论治疗药物是什么,长期获益者的总体预后均较好。因此,在制定维持患者生活质量和延长生存期的持续治疗策略中,采取个性化治疗方案与治疗强度较低的方案可能使这部分患者受益。当然,在STREAM研究的长期获益者中也观察到了瑞戈非尼的内在效应。
尽管在过去十几年间进行了多项临床研究,但RAS仍被视为一种“不可成药”的基因。然而,自STREAM研究开展以来,直接抑制RAS基因已成为包括CRC在内的多种实体瘤的可行性选择。基于可靠的临床前研究数据,几种KRAS G12C抑制剂目前正在研发中,可单独或与抗表皮生长因子受体药物或检查点抑制剂联合使用,以增强治疗效果。最近,AMG510和MRTX849研究中的联合治疗已显示出了令人鼓舞的初步结果。此外,基于已知的GP酶活性,KRAS G12D也是一种具有前景的治疗靶点。虽然已经有了初步进展,但开发RAS突变型mCRC的新治疗策略仍是临床尚未满足的需求,还需更多新药、新方案的进一步开发。

研究背景
胃腺癌和胃食管交界处腺癌(G/GEJ)的治疗存在未被满足的临床需求。目前,化疗是局部晚期不可切除或转移性G/GEJ患者的标准治疗方案,但生存期仅为1年。虽然靶向治疗联合化疗可延长患者生存期,但治疗有效的分子靶点有限,免疫治疗仅对CPS≥5的患者中有效。因此,亟需寻找新的治疗靶点, 而CLDN18.2阳性可能是一个潜在有效的治疗靶点。近日,《柳叶刀》发布了SPOTLIGHT试验的最新结果,比较了Zolbetuximab+ mFOLFOX6和安慰剂+mFOLFOX6在CLDN18.2阳性、HER2阴性局部晚期不可切除或转移性G/GEJ患者中一线治疗的疗效及安全性。
研究设计
SPOTLIGHT是一项全球性、随机、安慰剂对照、双盲、Ⅲ期试验, 565例局部晚期不可切除或转移性G/GEJ患者按1:1随机分组,283例患着接受Zolbetuximab+mFOLFOX6治疗,282例患者接受安慰剂+mFORFOX6治疗。主要终点为无进展生存期(PFS),关键次要终点包括总生存期(OS)。其他次要终点包括客观缓解率(ORR)、缓解持续时间(DOR)、安全性等。
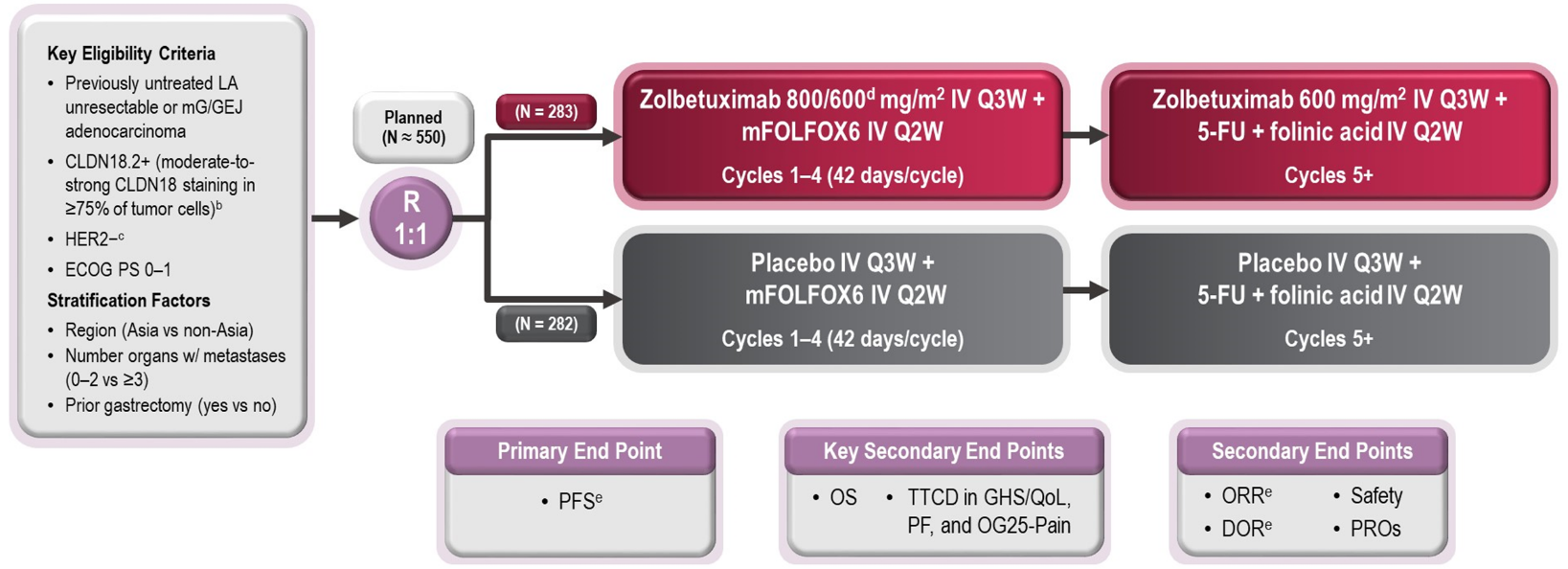
图1 研究设计
研究结果
主要终点PFS
与安慰剂相比,Zolbetuximab治疗组显著延长患者PFS。Zolbetuximab组和安慰剂组的中位PFS分别为10.61个月 vs 8.67个月(HR=0.75;95% CI:0.60-0.94,P=0.0066)。
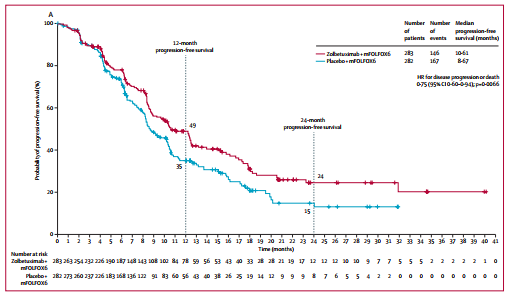
图2 PFS数据
关键次要终点OS
与安慰剂相比,Zolbetuximab治疗组显著延长患者OS。Zolbetuximab组和安慰剂组的中位OS分别为18.23个月 vs 15.54个月(HR=0.75;95% CI:0.60-0.94,P=0.0053)。
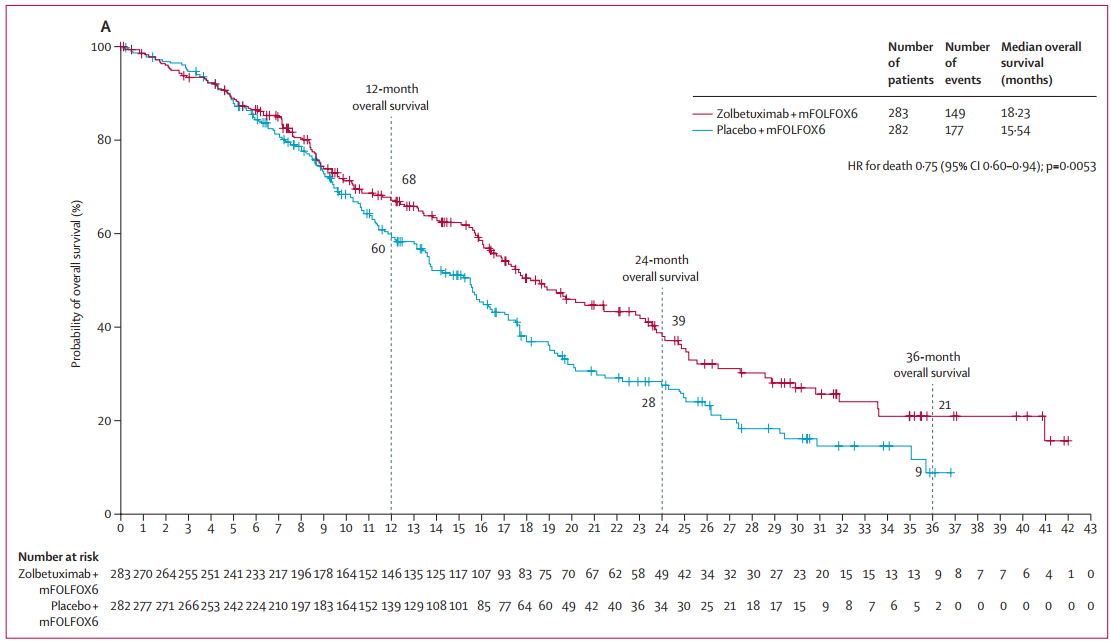
图3 OS数据
ORR、DOR
在全分析集(FAS)中,Zolbetuximab组和安慰剂组的ORR分别为48% vs.48%。DOR分别为9个月 vs.8.5个月。
安全性
在安全性方面,Zolbetuximab组≥3级紧急治疗相关不良事件(TEAE)发生率为87%(242/279),安慰剂组为78%(216/278)。Zolbetuximab组和安慰剂组最常见的TEAE为恶心(82% vs 61%)、呕吐(67% vs 36%)和食欲下降(47% vs 33%)。Zolbetuximab组有2%(5例)患者出现治疗相关死亡,安慰剂组有1%(4例)患者出现治疗相关死亡。没有发现新的安全性事件。
结论
对于CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性G/GEJ,与安慰剂组相比,Zolbetuximab联合 mFOLFOX6治疗可有效延长患者的PFS和OS,且未增加新的安全事件。因此,Zolbetuximab联合化疗有有望成为该部分患者新的一线治疗方案。
专家锐评

CLDN18.2是一种紧密连接蛋白,通常在正常胃粘膜细胞中表达,并在胃癌(42-86%)、胰腺癌(63%)、非小细胞肺癌(41%)和卵巢癌(15.4%)等多种肿瘤组织中均有表达。CLDN18.2的异常表达可能导致紧密连接的结构和功能发生改变,进而促进炎症、上皮间质转化(EMT)和肿瘤的发生进展。在恶性转化时,细胞极性丧失,CLDN18.2的抗原表位暴露于肿瘤细胞表面,可与药物结合,成为有前景的靶点。目前正在开发的靶向CLDN18.2药物包括单克隆抗体、ADC、CAR-T和双特异性抗体等。其中CLDN18.2单抗zolbetuximab是研发走在最前的药物。
先前的Ⅱ期FAST研究和ILUSTRO研究结果显示,zolbetuximab联合化疗可延长CDLN18.2高表达的局部晚期不可切除或转移性G/GEJ腺癌患者的生存期,且安全性良好。基于FAST和ILUSTRO研究的结果,III期SPOTLIGHT研究纳入了HER2阴性且CDLN18.2高表达(定义为在≥75%的肿瘤细胞中存在中至强CLDN18染色)的人群。既往的研究表明,CDLN18.2的表达与其他生物标志物(如HER2、PD-L1等)的重合度不高(约20%左右)。因此,在胃癌治疗领域,CLDN18.2可作为一个有治疗潜力的分子靶点和生物标志物。
SPOTLIGHT研究的结果显示,zolbetuximab联合化疗显著延长了HER2阴性且CDLN18.2高表达的局部晚期不可切除或转移性G/GEJ腺癌患者的生存期,中位PFS及OS分别为10.61个月和18.23个月,疾病进展风险及死亡风险均较对照组下降25%。仅接受化疗的对照组患者也表现良好,中位OS长达15.54个月,提示CLDN18.2可能是一个预后指标。在安全性方面,zolbetuximab联合化疗最常见的不良事件为恶心、呕吐和食欲下降,总体不良事件发生率较对照组稍高。
总而言之,SPOTLIGHT研究中的zolbetuximab+mFOLFOX6方案显著延长患者PFS和OS,在大部分亚组中获益相似,整体安全性可控可管理。该方案有望成为HER2阴性及CLDN18.2阳性局部晚期不可切除或转移性G/GEJ腺癌患者一种新的标准治疗手段。未来CLDN18.2抑制剂的研究方向可能集中在与其他治疗药物和方法的联合,如联合免疫治疗、联合其他靶向治疗和联合放疗等;以及前移至围手术期治疗领域。期待未来探索不止,通过对CLDN18.2的深入研究,进一步优化此类胃癌患者的生存获益。
参考文献
1. Strickler JH,et al. MOUNTAINEER investigators. Tucatinib plus trastuzumab for chemotherapy-refractory, HER2-positive, RAS wild-type unresectable or metastatic colorectal cancer (MOUNTAINEER): a multicentre, open-label, phase 2 study. Lancet Oncol. 2023;24(5):496-508.
2. Cardone C, De Stefano A, Rosati G, et al. Regorafenib monotherapy as second-line treatment of patients with RAS-mutant advanced colorectal cancer (STREAM): an academic, multicenter, single-arm, two-stage, phase II study. ESMO Open. 2023 Feb;8(1):100748.
3. Shitara K, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet. 2023;401(10389):1655-1668.
