GI医声 第3期 I 联合治疗助力消化道肿瘤高质量发展,勇创消化道肿瘤诊治新高地
医脉通 2023.09.21

GI 医声
13条内容

导读:消化道肿瘤是指发生在食管、胃、肠道及其附属器官的恶性肿瘤,其发病率一直居高不下。然而,晚期消化道肿瘤通常疗效有限,存在巨大的未满足临床需求。随着消化道肿瘤的治疗手段不断创新,联合治疗为消化道肿瘤带来新的希望。为此,本期GI医声特邀中南大学湘雅二医院肿瘤中心高娅文教授、山东省肿瘤医院李长征教授、海军军医大学附属长征医院苏宁教授、苏州大学附属第三医院胡文蔚教授分享消化道肿瘤联合治疗进展,以飨读者。

研究背景
Adagrasib是一种可口服的KRAS G12C小分子共价抑制剂,已在包括结直肠癌(CRC)在内的多种实体瘤患者中显示出临床治疗活性。临床前研究表明,KRAS G12C抑制剂联合表皮生长因子受体(EGFR)抑制剂可能是KRAS G12C突变mCRC患者一种有效的治疗策略。KRYSTAL-1研究评估了adagrasib单药或联合西妥昔单抗治疗KRAS G12C突变的mCRC患者,结果发表于2023年《新英格兰医学杂志》。
研究设计
KRYSTAL-1是一项1/2期开放标签、非随机临床研究,纳入KRAS G12C突变的、既往接受过治疗的mCRC患者,44例患者接受adagrasib单药治疗(600mg bid,口服),32例患者接受adagrasib(600mg bid,口服)+西妥昔单抗 qw(负荷量400mg/m2,维持量250mg/m2)或q2w(500mg/m2)联合治疗。研究主要终点为客观缓解率(ORR)和安全性。
研究结果
疾病缓解情况
单药治疗组和联合治疗组的中位随访时间分别为20.1个月和17.5个月,中位治疗时间分别为5.9个月和7.3个月。根据研究者评估,在单药治疗组(43例可评估患者)中,ORR为19%(95%CI:8-33),联合治疗组(28例可评估患者)为46%(95%CI:28-66);两组中位缓解持续时间(DOR)分别为4.3个月(95%CI:2.3-8.3)和7.6个月(95%CI:5.7-无法评估)。
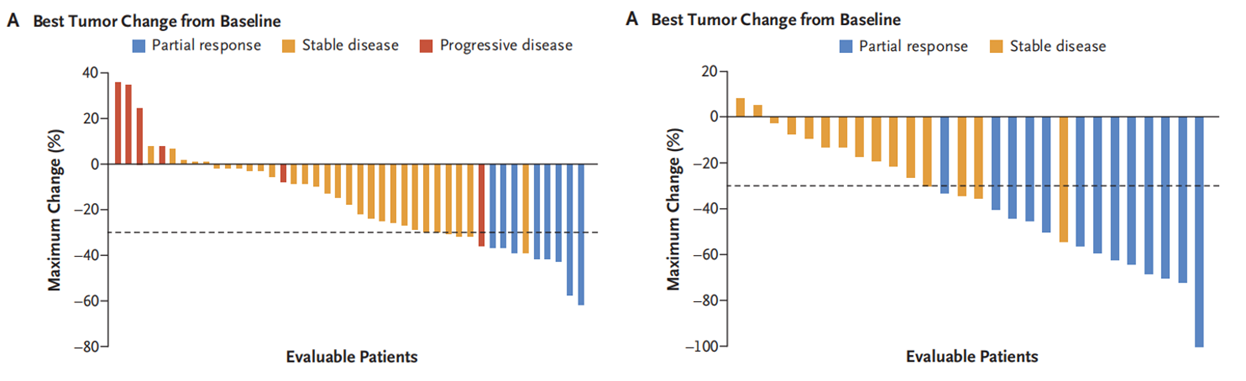
图1. 单药治疗组(左)和联合治疗组(右)对比基线的最佳肿瘤变化
PFS数据
在单药治疗组的中位无进展生存期(PFS)为5.6个月(95%CI:4.1-8.3),联合治疗组为6.9个月(95%CI:5.4-8.1)。
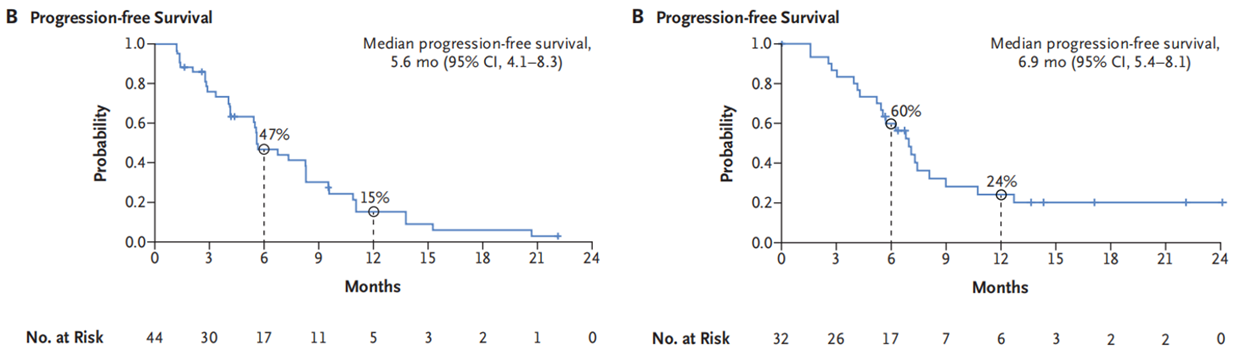
图2. 单药治疗组(左)和联合治疗组(右)的PFS数据
探索性分析
对ctDNA疗效的探索性分析显示,单药治疗组中16/29例(55%)和联合治疗组14/16例(88%)的患者在第2周期时KRAS G12C突变等位基因的血浆清除率≥95%。两组的应答率与患者基线是否存在TP53或PIK3CA突变没有明显的关联。
安全性数据
单药治疗组和联合治疗组发生任何级别的治疗相关不良事件(TRAE)的比例分别为93%和100%,3/4级TRAE发生率分别为34%和16%。未观察到5级不良反应。常见TRAE为腹泻、恶心、呕吐、疲劳等,普遍可逆。
研究结论
Adagrasib无论是作为单药治疗还是与西妥昔单抗联合治疗,都对经治疗的KRAS G12C突变mCRC患者具有抗肿瘤活性。且联合治疗组的中位DOR超过6个月。两组的不良反应常见且可逆。
专家锐评

KRAS G12C突变可见于3%-4%的mCRC患者,与其他KRAS突变或KRAS野生型CRC患者相比,其生存期更短。针对KRAS G12C突变的靶向药物的出现代表了这类人群一种新的治疗策略,KRYSTAL-1研究则为KRAS G12C在mCRC的治疗中可作为成药靶点提供了临床证据,证实了KRAS G12C抑制剂与EGFR抑制剂联合治疗在mCRC患者中具有抗肿瘤活性,且这一发现与既往临床前的观察结果一致。
mCRC中EGFR通路的重新激活作为对KRAS G12C抑制的适应性反应表明,共同抑制KRAS G12C和EGFR可能提高生物学活性。早期临床数据支持这一假设,在最近的一项1b期研究中,索托雷塞联合EGFR抑制剂帕尼单抗治疗KRAS G12C突变经治mCRC患者的ORR为30%,而索托雷塞单药治疗的ORR仅10%。在KRYSTAL-1研究中,adagrasib联合西妥昔单抗治疗的ORR为46%,中位DOR为7.6个月,中位PFS为6.9个月,这表明联合治疗可以提高临床获益。该研究中联合治疗组观察到的疗效获益与665例携带BRAF V600E突变mCRC患者中得出的结论一致,BRAF抑制剂与EGFR抑制剂的联合治疗较BRAF抑制剂单药更有可能改善治疗活性。Adagrasib+西妥昔单抗持久的疾病控制可转化为生活质量的改善,毒性没有叠加,观察到的TRAE与单药治疗一致。
KRYSTAL-1研究的ctDNA探索性分析提示,adagrasib+西妥昔单抗联合治疗的ctDNA缓解程度更高。TP53和PIK3CA突变是CRC中常见的突变,并被认为可能会影响治疗反应和KRAS抑制剂的敏感性。KRYSTAL-1研究对肿瘤分子特征的探索性分析显示,TP53和PIK3CA的共存突变与adagrasib的疗效无明显关联。另外,最新的数据表明,CRC对KRAS G12C抑制剂获得性耐药的潜在机制主要包括MAPK信号的再激活,未来基于KRYSTAL-1研究和其他研究的分析将有助于阐明相关机制。

研究背景
MSI-H型CRC患者是免疫治疗优势人群,但非MSI-H型CRC却对免疫治疗不敏感。为改善这一局面,一系列研究为预后较差的非MSI-H型mCRC患者提供了新的治疗方向。其中,瑞戈非尼联合免疫治疗对此类患者的疗效已在临床前模型和一些临床研究中得到证实。2023 ASCO发表的瑞戈非尼联合信迪利单抗的研究也继续为非MSI-H型mCRC患者的治疗“接力”,旨在为非MSI-H型mCRC患者寻找更为有效的后线治疗模式。
研究设计
这是一项单臂、开放标签、II期研究,研究共入组103例转移性mCRC患者,旨在评估瑞戈非尼(R)(80mg QD 3 /4周)联合信迪利单抗(S)(200mg 3周)后线治疗非MSI-H型mCRC患者的疗效和安全性。研究的主要终点为总生存期(OS)、关键次要终点为无进展生存期(PFS)、客观缓解率(ORR)、疾病控制率(DCR)和安全性
研究结果
疗效数据
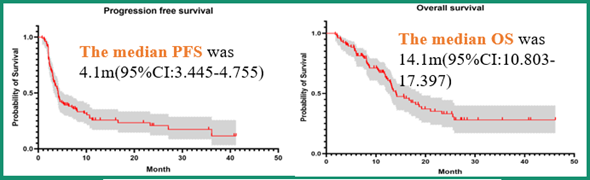
图1 R+S用于晚期非MSI-H型mCRC患者后线治疗的PFS(左)和OS(右)
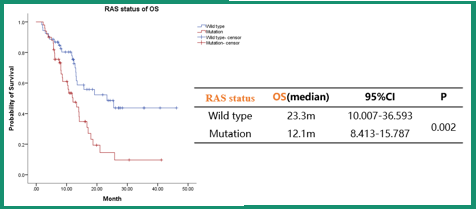
图2 R+S用于RAS野生型 vs.突变型非MSI-H型mCRC患者的OS
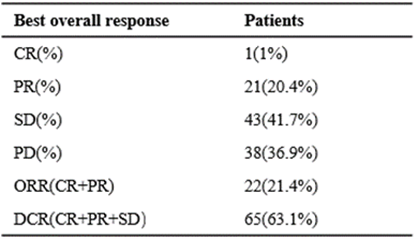
图3 R+S用于晚期非MSI-H型mCRC患者后线治疗的ORR和DCR
安全性数据
患者整体不良反应可耐受,安全性可控可管理。常见3~4级不良反应为手足综合征(1.9%)、口腔炎(1.9%)、皮疹(1.0%)、高血压(1.0%)、过敏(1.0%)、疲劳(1.0%)、发热(1.0%)等。
研究结论
瑞戈非尼联合信迪利单抗作为非MSI-H型mCRC患者后线治疗,表现出令人鼓舞的疗效,安全性可控,且 RAS野生型较突变型患者获益更为显著。该研究结果为非MSI-H型mCRC患者提供了一种新的治疗选择,有望优化非MSI-H型mCRC患者的后线治疗策略。
专家锐评

瑞戈非尼是一种口服抗血管生成抑制剂,能够改善肿瘤免疫微环境,具有免疫增敏作用。它通过靶向多种受体酪氨酸激酶,抑制血管生成和转移,调节肿瘤免疫环境,与免疫检查点抑制剂(ICIs)协同作用,使得"冷肿瘤"变为"热肿瘤",增强免疫系统对肿瘤的识别和清除。为非MSI-H型mCRC的治疗奠定了理论基础。这一免疫增敏作用,也得到了2023 ASCO“瑞幸组合”最新数据的支持。
前期REGONIVO研究瑞戈非尼联合PD-1抑制剂方案在非MSI-H型mCRC患者中的疗效,令大家看到了希望。得益于前期REGONIVO研究结果,国内也掀起了抗血管生成小分子TKI药物联合免疫治疗的研究热潮。2023 ASCO 公布的 “瑞幸组合”研究,是目前国内研究者发起的样本量最大的靶免联合治疗非MSI-H型mCRC的前瞻性研究。结果显示,瑞戈非尼联合PD-1单抗在非MSI-H型mCRC患者后线治疗的OS长达14.1个月,这为mCRC后线靶免联合治疗的探索提供了有力依据。
此外,该研究中也针对RAS野生型和突变型进行了亚组分析,结果显示,RAS野生型患者的PFS和OS比突变型更好。一些野生型mCRC患者在治疗后病情持续缓解,生活质量改善,并获得了长期生存。为了进一步了解这些患者肿瘤微环境的变化,研究者正在进行基因测序和免疫微环境的检测。未来仍需要继续研究潜在的疗效相关分子标志物,以探索靶免治疗精准获益人群。

研究背景
瑞戈非尼是结直肠癌肝转移(CRLM)三线及以上治疗的一款口服多激酶抑制剂(TKI),手足综合征(HFS)是其常见的不良反应。塞来昔布是一种选择性COX-2抑制剂,具有抗炎作用。2023ASCO会议上发表的“塞来昔布对结直肠癌肝转移患者瑞戈非尼相关手足综合征的预防效果:一项单中心、回顾性、真实世界研究”提示,联合应用塞来昔布具有降低瑞戈非尼严重HFS的趋势,并且不会缩短患者的生存期3。本研究旨在探讨在肿瘤治疗中加入塞来昔布是否能预防或减轻HFS,提高药物耐受性,延长患者的生存。
研究设计
这项回顾性队列分析,纳入了2021年11月至2022年10月在北京肿瘤医院肝胆胰外科接受瑞戈非尼和塞来昔布治疗的CRLM患者。根据检查报告及其他随访记录,使用Kaplan–Meier曲线估计患者生存期,采用CTCAE v.5.0标准描述不良事件的严重程度。
研究结果
研究共纳入26例患者,14例结直肠癌患者在治疗开始时已发生肝外转移。所有患者均接受了瑞戈非尼和塞来昔布治疗。15例患者接受了免疫检查点抑制剂联合治疗,3例患者接受了局部联合治疗,1 例患者接受了化疗联合治疗,7例患者接受了仅瑞戈非尼治疗。
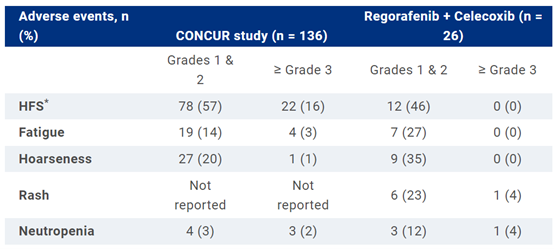
在整体人群中,1~2级HFS的发生率为46%,3级HFS的发生率为0%。其他主要不良事件包括乏力、声音嘶哑、皮疹和中性粒细胞减少。CONCUR研究和当前分析中最常见的不良事件见表1。
表1 CONCUR研究和当前分析的最常见不良事件
5例(19%)患者因不良事件停止治疗或减少药物剂量。所有患者的中位随访时间为5.3个月,总生存期(OS)尚未达到,中位无进展生存期(PFS)为2.9个月(95% CI: 1.5-4.3)。治疗后,部分缓解(PR)3例(12%),疾病稳定(SD)11例(42%),疾病进展(PD)12例(46%)。
研究结论
CRLM患者采用瑞戈非尼联合塞来昔布,虽不能降低HFS的发病率,但能降低HFS的严重程度(3级),并且不会缩短患者的生存期。
专家锐评

CRLM是晚期结直肠癌常见的转移部位,约50%的结直肠癌患者在病程中会发生肝转移,使预期5年总体生存率大幅降低,成为结直肠癌患者死亡的主要原因。手术完全切除肝转移灶是目前能治愈CRLM的最佳方法。但近年来国内外研究均发现,肝转移切除术后具有较高的复发率,严重影响了CRLM患者的整体生存情况4,因此绝大多数晚期结直肠癌患者会在病程中进入三线及后线治疗中。
瑞戈非尼是一种口服多靶点TKI,可以阻断数个促血管生成的血管内皮生长因子受体(VEGFR)、抑制与肿瘤生成和肿瘤微环境相关的多种激酶的活性。国内外指南/规范一致高循证级别推荐瑞戈非尼作为转移性结直肠癌三线标准治疗方案。然而,HFS是瑞戈非尼主要的不良反应之一,影响了患者用药的连续性和有效性,甚至部分患者因不良反应停药。
众所周知,HFS是一种手掌部和足底红斑性皮肤损害,是很多抗肿瘤药物常见的副作用之一。从机制上来讲,抗肿瘤药物引起HFS的原因主要包括:环氧化酶介导的炎症反应;毛细血管损伤;药物及代谢产物蓄积学说;代谢酶的差异分布。
有研究显示,对于中重度和所有等级HFS,COX-2抑制剂塞来昔布是可以有效预防HFS发生的影响因素5。并且,欧洲肿瘤内科学会(ESMO)发布的《抗癌药物相关皮肤毒性预防与管理临床实践指南》也推荐塞来昔布预防HFS6。本研究发现,对于接受瑞戈非尼治疗的CRLM患者,联用塞来昔布后3级HFS的发生率降为0,客观缓解率(ORR)达12%。
此外,目前多项研究还提示,瑞戈非尼联合塞来昔布对免疫治疗具有增敏作用7,瑞戈非尼联合塞来昔布和免疫治疗或将是CRLM后线治疗的新选择,期待更多临床数据予以验证。

研究背景
PD-1抑制剂特瑞普利单抗用于晚期食管鳞状细胞癌(ESCC)患者的一线治疗效果已被证实。然而,对于可行根治性放化疗的局部晚期食管鳞状细胞癌而言,免疫治疗疗效还有待进一步研究。2023年4月,中山大学肿瘤防治中心放疗团队在国际著名肿瘤学期刊《柳叶刀·肿瘤学》(The Lancet Oncology;IF:54.433)上发表了PD-1抑制剂联合根治性放化疗治疗局部晚期食管癌的单臂II期研究(EC-CRT-001研究)结果8,受到学界广泛关注。,EC-CRT-001试验旨在探究不可切除、局部晚期食管癌接受根治性放化疗联合特瑞普利单抗的疗效、安全性及潜在生物标志物。
研究设计
EC-CRT-001研究是一项在中国广州中山大学肿瘤防治中心独立进行的单臂、II期试验。入组条件为18至70岁、ECOG体能状态(PS)评分为0-2、未接受过既往治疗、不可切除的Ⅰ-ⅣA期食管鳞癌患者。入组患者同时接受胸部放疗(28次,50.4Gy)、化疗(每周紫杉醇静注,50mg/m2 ;顺铂,25mg/m2 ;五个周期)、特瑞普利单抗(240mg,静注,Q3W,持续1年或直至疾病进展或出现不耐受的毒性)。研究的主要终点为研究者评估的放疗后3个月的完全缓解(CR)率;次要终点为总生存期(OS)、无进展生存(PFS)、缓解持续时间、生活质量和安全性。
研究结果
2019年11月12日至2021年1月25日期间,研究共纳入42例患者。患者中位年龄56岁,42例患者中有39例(93%)为Ⅲ/ⅣA期。在42例患者中有40例(95%)患者完成放化疗,26例(62%; 95% CI 46–76)患者达到CR。中位缓解持续时间为12.1个月(95% CI 5.9–18.2)。中位随访14.9个月,1年OS率为78.4%(95% CI 66.9–92.0),1年PFS率为54.5%(41.3–72.0)。
表1 EC-CRT-001研究中有效性结果
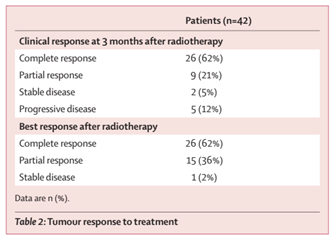
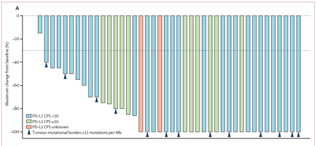
图1 全组患者的最佳疗效瀑布图
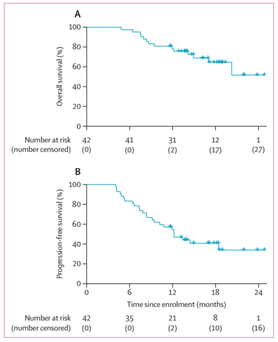
图2 EC-CRT-001研究中OS(A)和PFS结果(B)
在安全性方面,最常见的3级及以上不良事件为淋巴细胞减少症;最常见的不良事件为淋巴细胞减少、白细胞下降和食管炎。
研究结论
综上所述,特瑞普利单抗联合放化疗在局部晚期食管鳞癌治疗中具有较好的疗效和可控的安全性,值得进行更大规模的临床研究以验证该联合方案的临床获益。
专家锐评

食管癌是消化道领域最常见的恶性肿瘤之一,发病率和死亡率均位居国内恶性肿瘤前列。食管鳞癌和腺癌是食管癌的两种主要组织学亚型,中国患者以食管鳞癌为主要亚型,约占总体发病率的90%。对于晚期食管鳞癌患者,当前一线标准治疗多采用以铂类为基础的化疗方案,但临床获益有限,迫切需要新的药物和治疗方案来延长患者的生存期。免疫治疗的兴起为食管鳞癌的治疗“注入了新的力量”,2019年KEYNOTE-181发布结果,对于PD-L1 CPS≥10的食管癌的二线治疗,帕博利珠单抗显著优于化疗。一石激起千层浪,免疫治疗让食管鳞癌的药物治疗与全身治疗领域燃起希望之光9。
众所周知,免疫检查点抑制剂通过靶向PD-1、PD-L1等分子,解除肿瘤免疫抑制,激活体内已有的抗肿瘤免疫而发挥作用。目前食管鳞癌中有多项免疫检查点抑制剂Ⅰ-Ⅲ期临床研究正在开展。EC-CRT-001研究首次证实了免疫治疗联合放化疗治疗不可切除的局部晚期食管鳞癌患者具有较好的疗效及安全性。该研究为食管鳞癌患者群体的治疗策略提供了新思路。此外,在这项研究中,除常规观察临床疗效、生存期、安全性等,研究者还探索了预测疗效的生物标志物,包括免疫微环境的分析、ctDNA的动态监测以及DNA的测序分析等,以期探索更精准的获益人群。
食管鳞癌药物开发领域沉寂已久,免疫治疗的兴起为食管鳞癌治疗带来新的契机。以PD-1/PD-L1抑制剂为代表的免疫治疗在食管鳞癌中展现出令人鼓舞的疗效和前景,同时联合治疗也在持续深入开发中,并有望取长补短、相得益彰,形成技术合力,使得食管鳞癌的免疫治疗之路越走越宽,为广大食管癌患者带来新的希望8,9。
参考文献
1. Yaeger R, et al. Adagrasib with or without Cetuximab in Colorectal Cancer with Mutated KRAS G12C. N Engl J Med. 2023 Jan 5;388(1):44-54.
2. Liu R,et al. A phase II study of regorafenib plus sintilimab as salvage-line treatments in non–MSI-H metastatic colorectal cancer (mCRC). 2023 ASCO Abstract #3652.
3. Wang L, Wang H, Liu W, et al. The preventive effect of celecoxib on regorafenib-associated hand-foot syndrome in patients with liver metastasis from colorectal cancer: A single-center, retrospective, real-world study. J Clin Oncol 41, 2023 (suppl 16; abstr e15576).
4. 宋华传,王继洲. 结直肠癌肝转移手术切缘问题研究进展[J]. 中国实用外科杂志,2023,43(2):216-220,225.
5. Macedo LT, Lima JP, dos Santos LV, et al. Prevention strategies for chemotherapy-induced hand-foot syndrome: a systematic review and meta-analysis of prospective randomised trials. Support Care Cancer. 2014 Jun;22(6):1585-93.
6. Lacouture ME, Sibaud V, Gerber PA, et al. Prevention and Management of Dermatological Toxicities Related to Anticancer Agents: ESMO Clinical Practice Guidelines[J]. Ann Oncol, 2021;32(2):157-170.
7. Pu D, Yin L, Huang L, et al. Cyclooxygenase-2 Inhibitor: A Potential Combination Strategy With Immunotherapy in Cancer. Front Oncol. 2021 Feb 26;11:637504.
8. Zhu Y, et al. Toripalimab combined with definitive chemoradiotherapy in locally advanced oesophageal squamous cell carcinoma (EC-CRT-001): a single-arm, phase 2 trial. Lancet Oncol. 2023;24(4):371-382.
9. 吴浦嫄. 食管鳞状细胞癌免疫治疗的研究进展.中国肿瘤生物治疗杂志. 2020;27(9):1043-1049.
