GI医声 第4期 I 靶免联合化疗或将成为新主流,消化道肿瘤治疗有望迎来新方案
医脉通 2023.09.26

GI 医声
13条内容

导读:消化道肿瘤是危害国民健康的重大卫生问题,包括结直肠癌、胃癌、食管癌等。消化道肿瘤病情复杂、易复发转移,是肿瘤治疗领域的“硬骨头”。近年来,以靶向和免疫疗法为代表的精准治疗快速进步,以及化疗新方案的出现,使得当前的消化道肿瘤的整体疗效得到很好的提升。目前,靶免联合化疗的尝试疗效初显,本期GI医声特邀贵州省人民医院王姿教授、天津市人民医院阎皓教授、中山大学附属第六医院翟晓慧教授、浙江大学医学院附属邵逸夫医院韩卫东教授分享消化道肿瘤靶免联合化疗的治疗进展,期待为消化道肿瘤的治疗提供新思路。

研究背景
少数前瞻性研究提示,对于初始不可切除的结直肠癌肝转移患者进行诱导全身治疗后,11%-57%的肝转移灶可能转化为可切除状态,但这些研究并未证实适合用于诱导治疗的最佳方案。而且由于RAS/BRAF V600E突变状态的人群筛选存在异质性,这些研究也同样不能对该类人群的结局给出合理解释。基于此,研究者开展了CAIRO5研究,旨在为初始不可切除的结直肠癌肝转移患者探索最佳的全身诱导治疗方案。
研究设计
这项开放标签、多中心、随机III期研究CAIRO5的纳入标准为年龄≥18岁、WHO评分为0-1、RAS/BRAF状态已知且经组织学评估确认的结直肠癌肝转移患者。右侧原发肿瘤或RAS/BRAF突变型患者按1:1随机分配至接受FOLFOX或FOLFIRI联合贝伐珠单抗(A组)或FOLFOXIRI联合贝伐珠单抗治疗(B组);左侧原发肿瘤且RAS/BRAF野生型患者按1:1随机分配至接受FOLFOX或FOLFIRI联合贝伐珠单抗(C组)或FOLFOX或FOLFIRI联合帕尼单抗治疗(D组)。研究的主要终点是改良意向治疗人群(mITT)的无进展生存期(PFS),次要研究终点包括R0-1切除率、总生存期(OS)、客观缓解率(ORR)和安全性等。
研究结果
PFS数据
经过中位51.1个月的随访后,A组和B组的中位PFS分别为9.0个月和10.6个月(HR=0.76;95%CI:0.60-0.98;P=0.032)。经过中位49.9个月的随访后,C组和D组的中位PFS分别为10.8个月和10.4个月(HR=1.11;95%CI:0.48-1.48;P=0.46)。
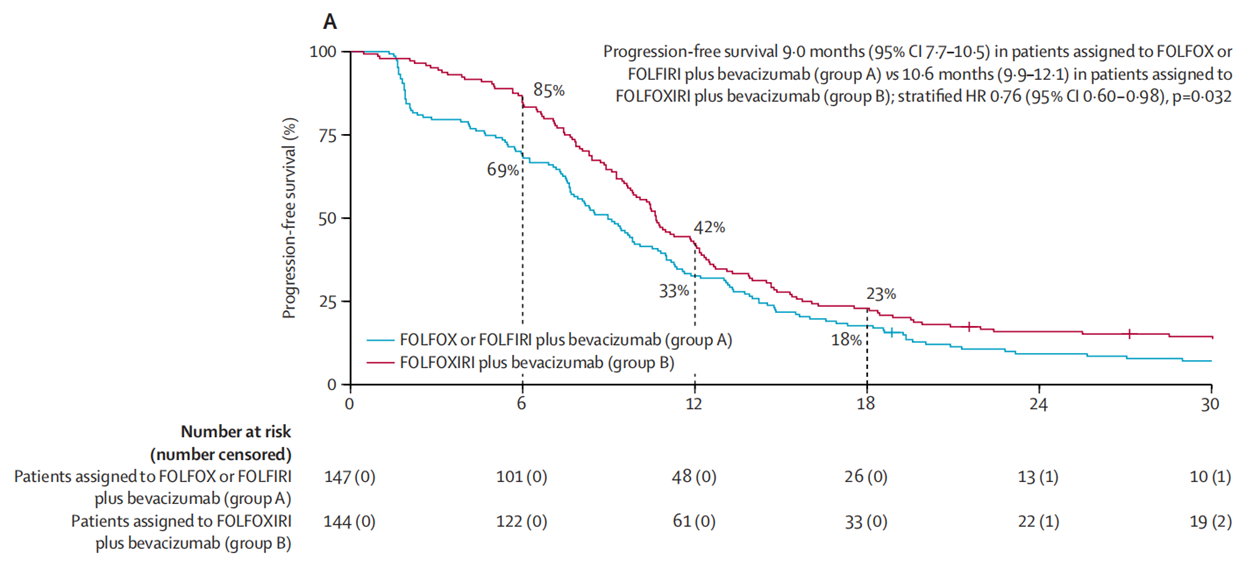
图1. CAIRO5研究A组和B组的PFS数据
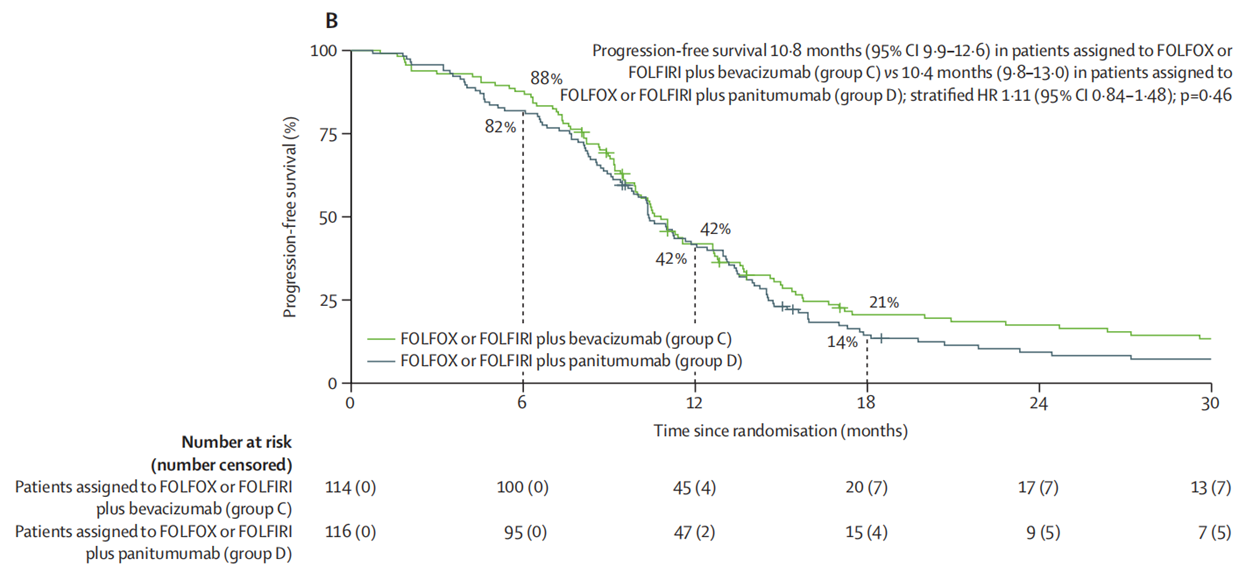
图2. CAIRO5研究C组和D组的PFS数据
ORR数据
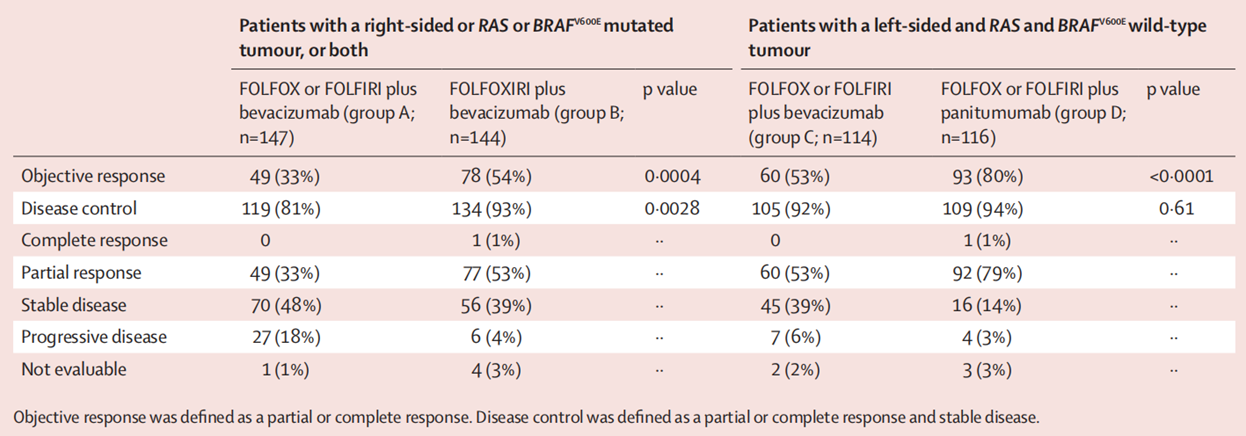
A组和B组的ORR分别为33%和54%(P=0.0004),疾病控制率(DCR)分别为81%和93%(p=0.0028)。C组和D组的ORR分别为53%和80%(p<0.0001),DCR分别为92%和94%(p=0.61)。
表1. CAIRO5研究四组的ORR、DCR数据
安全性数据
≥3级不良事件的发生率,在A组和B组分别为59%和76%(p=0.0027),在C组和D组发生率分别为54%和69%(p=0.021)。A组和B组中最常见的3/4级不良事件为中性粒细胞减少症、高血压和腹泻。C组和D组最常见的3/4级不良事件包括中性粒细胞减少症、皮肤毒性、高血压和腹泻。
研究结论
对于初始不可切除的右侧原发肿瘤或RAS/BRAF突变型结直肠癌肝转移患者,FOLFOXIRI+贝伐珠单抗可作为诱导全身治疗的首选方案。而对于左侧原发肿瘤且RAS/BRAF野生型结直肠癌肝转移患者,化疗联合帕尼单抗相较于化疗联合贝伐珠单抗并无明显临床获益,且该方案的不良事件发生率更高。该研究的长期疗效数据有待进一步的随访和分析。
专家锐评

CAIRO5研究是首个在结直肠癌肝转移患者中,基于RAS/BRAF V600E突变状态和原发肿瘤的部位(左或右),前瞻性地对比了当下临床常用标准方案:两药/三药化疗联合贝伐珠单抗和抗EGFR单抗(帕尼单抗)的随机对照临床研究,为肝转移患者探寻更精准的治疗方案。研究结果发现,在初始不可切除的右侧原发肿瘤或RAS/BRAF突变型结直肠癌肝转移患者中,相较FOLFOX或FOLFIRI联合贝伐珠单抗,FOLFOXIRI+贝伐珠单抗可显著改善患者的PFS、ORR和R0-1切除率等,能争取更高的转化成功率及生存获益,具有重要临床指导意义。值得注意的是,更强的三药方案伴随更高的不良反应,在临床实践中,明确转化为目标,还需全面评估,筛选体能状态好、适合强烈治疗的患者,更可能从中获益。
CAIRO5研究是根据荷兰、比利时肝脏外科专家达成的普遍共识建立了透明、统一的入组标准,纳入了所有初始不可切除的结直肠癌肝转移患者,并根据目前最相关的预后和预测参数进行分层。尽管部分患者可进行前期局部治疗,但也可能在围手术期接受全身治疗,且患者按照是否可切除进行分层,因此尽最大可能减少了治疗组之间的不平衡。另外,CAIRO5研究设置了肝脏专家小组在随访期间对可切除性进行评估,相对单个专家,极大地降低了患者选择局部治疗的限制。
另外,研究者发现,对于左侧原发肿瘤且RAS/BRAF野生型结直肠癌肝转移患者,抗EGFR单抗治疗的PFS获益并不优于贝伐珠单抗,这与之前未选择转移部位的相关研究结果一致,然而,基于既往FIRE-3、CALGB/SWOG 80405、PARADIGM等研究OS数据,较贝伐珠单抗,抗EGFR单抗能带来更长的OS获益,当下临床实践中,抗EGFR单抗仍为左侧原发肿瘤、RAS/BRAF野生型转移性结直肠癌患者首选靶向药物。对于这些结果的相关原因分析未来还需进一步探索,以及等待CAIRO5研究的最终随访结果。

研究背景
瑞戈非尼作为靶向治疗药物,可以抑制肿瘤血管生成和肿瘤细胞增殖,其独特的作用机制和与其他药物副作用不重叠的特性使其成为一种理想的联合治疗药物。将瑞戈非尼与化疗药物联合应用,可以在两种不同的方向上对肿瘤细胞进行打击,提高治疗效果。根据初步I期研究REMETY研究显示,瑞戈非尼联合TAS-102 的4周标准治疗方案可行且安全,但该研究中TAS-102治疗剂量仅25 mg/m² bid。因此,特开展了REGTAS研究,旨在评估瑞戈非尼联合TAS-102治疗mCRC的疗效、安全性和最佳剂量搭配。该研究结果在2023 ASCO会议上公布。
研究设计
REGTAS是一项多中心II期临床试验,纳入5个中心16例既往治疗失败的mCRC患者,其中13例接受过至少一次评估。11例(68.7%)的患者在确诊后18个月内入组,8例(50%)患者检测到RAS突变。在体能状况允许的情况下,采用瑞戈非尼联合TAS-102治疗难治性mCRC。推荐的两种药物剂量为瑞戈非尼120mg/d(或起始剂量80mg/d,随后每周40mg剂量递增至120mg/d),每21天为一个周期;TAS-102 30 mg/m²,每天两次,给药时间为第1~5天,每两周为一个周期。主要终点为无进展生存期(PFS)。次要终点包括安全性、疾病控制率(DCR)和总生存期(OS)。
研究结果
疗效数据
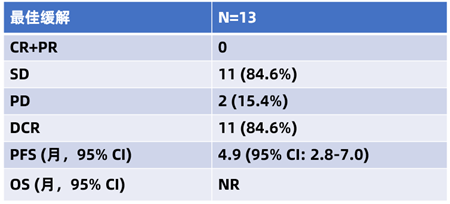
截至2022年12月31日,在疗效可评估的13 例患者中,11例患者达到疾病稳定(SD),2例患者出现疾病进展(PD)。患者中位 PFS 为4.9个月 (95%C:2.8-7.0),中位OS未达到。整体患者的疾病控制率(DCR)达到 84.6%(95% CI:54.6%-98.1%)(表1)。
表1 REGTAS研究疗效数据
安全性数据
患者整体安全性良好,所有患者都出现了治疗相关不良事件(TRAE),其中4例(25%)患者发生≥3级不良反应,2例(9.5%)患者需要减少瑞戈非尼剂量。常见的不良反应包括手足综合征(62.5%)、高血压(68.8%)、疲劳(50%),中性粒细胞减少(43.8%)等。
研究结论
瑞戈非尼联合TAS-102的临床获益令大家看到了希望,二者联合治疗不良反应可控可耐受,可能为晚期mCRC患者的治疗提供新的治疗选择。未来仍需要进一步的研究来验证这一方案。
专家锐评

mCRC三线治疗的目标是提高患者生活质量、延长生存时间。从REGTAS研究结果来看,瑞戈非尼120mg/d联合TAS-102 30 mg/m² bid临床疗效优于单药治疗,并且不良反应发生率低,能够满足患者的治疗需求。但REGTAS研究结果有望进一步提高,先前的REMETY研究显示,与TAS-102 25mg/m² bid剂量组相比,35mg/m² bid剂量组的病理完全缓解率(pCR)明显提高。REGTAS研究使用的TAS-102 30mg/m² bid没有出现剂量下调的情况。因此,目前该剂量在安全性方面是可耐受的。从疗效角度来看,目前REGTAS研究已入组患者的肿瘤退缩程度相对较低,大部分处于稳定状态。这提示或许目前REGTAS研究的剂量设计不是最佳选择,在安全性方面过于保守。未来需要进一步探索,根据患者情况进行个体化剂量设计,以合理平衡疗效和安全性。
先前的SUNLIGHT研究中尝试了贝伐珠单抗联合TAS-102的治疗方案,在SUNLIGHT研究中,对于一线及跨线使用过贝伐珠单抗的患者,目前尚无数据证明他们是否会获益,这也是未来瑞戈非尼联合TAS-102需要重点探索的人群。未来应专注于优势人群的选择,进一步筛选出适合瑞戈非尼联合治疗的受益人群。
在mCRC领域,不同方式的联合治疗方案取得了一定的成绩。然而,将两种标准的三线治疗药物直接进行联合使用的研究很少。REGTAS研究为临床实践开辟了新的思路。且瑞戈非尼和TAS-102都是口服药物,方便患者服用。目前二者的联合在mCRC后线治疗已经证明具有一定的疗效,安全性可耐受。未来可尝试将其用于前线治疗,并积极探索更多的联合治疗方案,帮助mCRC患者实现更长的生存和更好的生活质量。

研究背景
瑞戈非尼是一种新型的多靶点、小分子酪氨酸激酶抑制剂(TKI),与免疫检查点抑制剂(ICI)联合使用时,可调节肿瘤微环境以发挥协同效应,难治性胃食管癌的相关研究也证实了多靶点TKI(包括瑞戈非尼)联合PD-1抑制剂具有良好的抗肿瘤活性。然而,此前一项II期研究显示,瑞戈非尼联合FOLFOX化疗方案(氟尿嘧啶、亚叶酸钙、奥沙利铂)一线治疗未能改善胃食管癌患者的预后,近期,柳叶刀子刊发表了一项旨在评估瑞戈非尼与纳武利尤单抗和FOLFOX化疗方案联合治疗晚期胃食管癌的单臂、单中心、II期研究结果。
研究设计
研究纳入年龄≥18岁、ECOG PS评分为0或1、既往未经治疗的HER2阴性转移性胃食管癌患者,接受FOLFOX化疗(氟尿嘧啶[400mg/m²推注,随后2400mg/m²持续48h],亚叶酸钙[400mg/m²],奥沙利铂[85mg/m²])和纳武利尤单抗(240mg,第1天和第15天)治疗,并在治疗周期的第1-21天口服瑞戈非尼(80mg),28天为一个周期。
研究主要终点是6个月无进展生存期(PFS),次要终点包括安全性、客观缓解率(ORR)、临床获益率(CBR)、中位总生存期(OS)和12个月OS率、中位PFS和12个月PFS率。
研究结果
PFS数据
数据截止时,患者中位随访时间为18.1个月。研究达到了主要终点,35例患者中有25例(71%;95%CI:54-85)治疗6个月时疾病无进展。中位PFS为13.0个月(95%CI:7.6-未达到),6个月和12个月的PFS率分别为71%(95%CI:58-88)和51%(95%CI:37-71)。
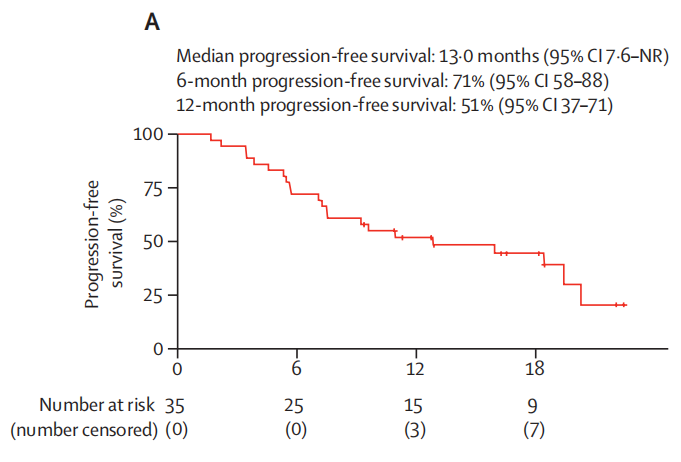
图1. 患者6个月和12个月的PFS率
OS数据
中位OS尚未达到,6个月和12个月的OS率分别为97%(95%CI:92-100)和85%(95%CI:74-98)。
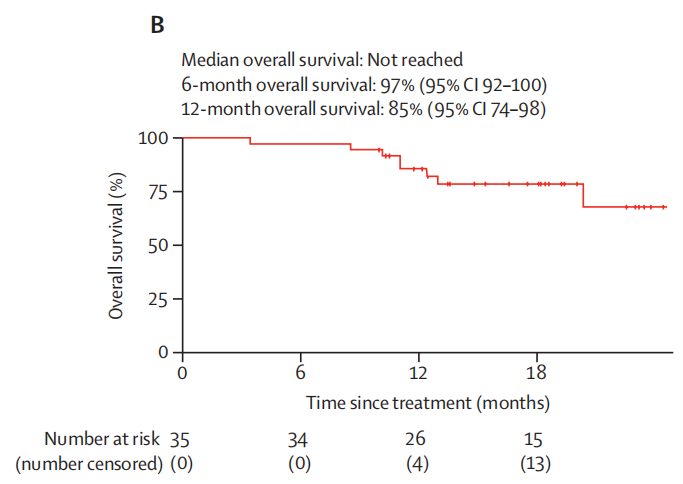
图2. 患者6个月和12个月的OS率
CBR、ORR数据
35例患者的CBR为97%(95%CI:85-99),ORR为76%,中位缓解持续时间(DOR)为17.0个月(95%CI:57-NR)。
安全性数据
任何级别的不良事件(AE)发生率为97%,最常见的AE为疲劳(92%);≥3级不良事件的发生率为79%,最常见的是中性粒细胞减少(46%)、高血压(15%)等。未出现治疗相关死亡。
研究结论
本项研究结果显示,瑞戈非尼联合纳武利尤单抗和化疗治疗HER2阴性晚期胃食管癌具有良好的抗肿瘤活性和可控的安全性。该研究结果的公布也将支持未来开展瑞戈非尼联合治疗的相关研究,该方案也正在开展III期随机对照临床研究,期待结果的公布。
专家锐评

CheckMate-649等研究确立了PD-1单抗联合化疗在晚期胃癌治疗中的一线地位。免疫检查点抑制剂的加入让晚期胃癌患者获得了生存的获益,3年的生存率达到了17%,其中大部分患者会产生治疗耐药。免疫检查点抑制剂治疗抵抗的原因有免疫反应不足、自我耐受、以及免疫抑制微环境引起的T细胞招募不足。在胃食管癌中,T细胞浸润低会引起免疫耐受,这与髓源性T细胞、调节性T细胞、肿瘤相关性巨噬细胞、耐受性树突状细胞以及TGF-β的活性相关。探索PD-1抑制剂联合同靶向药疗效的研究都在进行。伊匹木单抗,是抗CTLA-4的抗体,能够对调节性T细胞进行调节,在CheckMate-649的肿瘤标志物研究中发现,调节性T细胞高表达的患者可在伊匹木单抗联合纳武利尤单抗的治疗中获益,且与PD-L1的表达无关。
多靶点的酪氨酸激酶抑制剂,比如瑞戈非尼,可以激活和增强天然杀伤细胞以及CD8+T细胞的功能,同时能够对肿瘤免疫抑制必需的巨噬细胞和调节体细胞的途径产生抑制作用,从而增加免疫细胞的浸润。酪氨酸激酶抑制剂与免疫检查点抑制剂联用可以增强肿瘤的免疫微环境。在胃食管癌的研究中发现,PD-1联合多靶向酪氨酸激酶抑制剂(包括瑞戈非尼)具有很好的抗肿瘤活性。在很多晚期肿瘤中,瑞戈非尼都能延长PFS和OS。但是在一线治疗胃食管癌的研究中,FOLFOX方案联合瑞戈非尼并未显示出获益。
这项2期研究旨在探索,在晚期胃癌标准一线的治疗基础上,瑞戈非尼的加入是否安全,是否能够增加抗肿瘤的免疫反应,同时进行了生物样本的分析。结果显示,瑞戈非尼联合纳武利尤单抗和化疗是安全有效的。虽然只是小样本的2期研究,也为晚期胃癌的一线治疗提供了新的视角。该研究方案是否临床可行,还需要大型的3期临床研究进行验证。

研究背景
晚期或转移性食管鳞癌的一线治疗方案较少,且疗效并不理想。PD-1抑制剂替雷利珠单抗在既往治疗的晚期食管鳞癌患者中显示出抗肿瘤活性。2023年4月17日,Lancet Oncology(IF=54)在线发表RATIONALE-306研究结果,旨在评估替雷利珠单抗+化疗对比安慰剂+化疗用于晚期或转移性食管鳞癌患者一线治疗的疗效和安全性,为食管鳞癌一线治疗提供了新的选择。
研究设计
RATIONALE-306研究是一项全球、随机、双盲、平行、安慰剂对照、III期临床研究。患者来自亚洲、欧洲、大洋洲和北美的162个中心。研究纳入年龄≥18岁、组织学确诊、不可切除、局部晚期、复发或转移性食管鳞癌患者,这些患者既往未接受过针对晚期疾病的全身性治疗。患者以1:1的比例随机分配至替雷利珠单抗+化疗组或安慰剂+化疗组。治疗直至疾病进展、不可耐受的毒性、死亡或患者撤销知情同意书。主要研究终点为总生存期(OS)。
研究结果
2018年12月12日至2020年11月24日期间,入组了649例患者。数据截止时,替雷利珠单抗组和安慰剂组的中位随访时间分别为16.3个月和9.8个月。替雷利珠单抗组326例患者中有196例(60%)死亡,安慰剂组323例患者中有226例(70%)死亡。替雷利珠单抗组中位OS为17.2个月(95% CI,15.8-20.1),安慰剂组为10.6个月(95%CI:9.3–12.1)(分层HR,0.66[95%CI:0.54-0.80];单侧P<0.0001)。
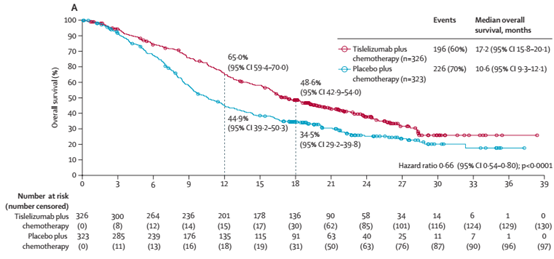
图1 意向治疗人群的OS情况
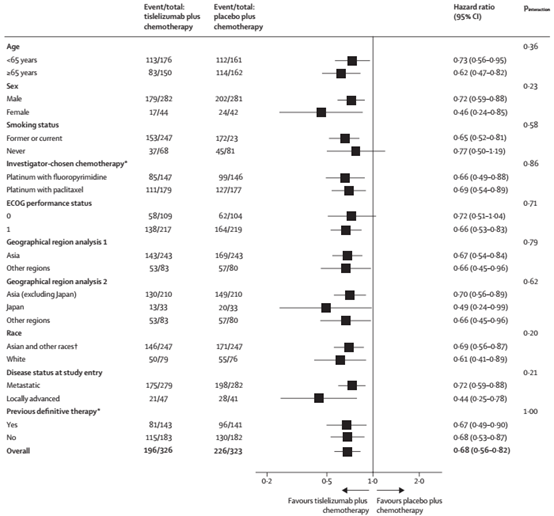
图2 预先指定的OS亚组分析
与安慰剂+化疗组相比,替雷利珠单抗+化疗组患者的中位PFS也明显延长(中位PFS分别为7.3个月vs 5.6个月,P<0.0001)。
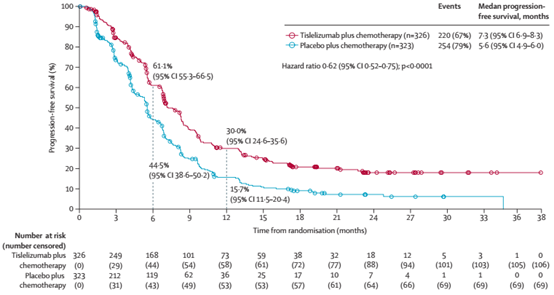
图3 研究者评估的PFS情况
此外,替雷利珠单抗组207例(63%)患者和安慰剂组的137例(42%)患者达到研究者评估的客观缓解,比值比为2.38(95%CI:1.73-3.27;P<0.0001)。
安全性方面,替雷利珠单抗联合用药的安全性特征与其既往试验一致。最常见的≥3级TRAE包括中性粒细胞计数减少、白细胞计数减少和贫血。
研究结论
RATIONALE-306研究提示,与安慰剂+化疗相比,替雷利珠单抗+化疗作为晚期或转移性食管鳞癌的一线治疗方案提供了较好的生存获益和可管理的安全性。
专家锐评

食管癌是全球第十大常见癌症,也是癌症相关死亡的第六大原因。超过三分之二的食管癌患者被诊断为晚期或转移性食管癌;区域性淋巴结转移的5年生存率为26%,远处转移的5年生存率为5%。食管鳞癌约占所有食管癌的90%。对于晚期或转移性食管鳞癌患者,推荐的一线治疗方案通常是铂类(顺铂或奥沙利铂)方案联合氟嘧啶或紫杉醇,然而中位OS往往不足10个月4。
近年来,免疫治疗在多种肿瘤治疗中“开疆拓土”,其在食管癌治疗中也具有广阔的应用前景。与化疗相比,PD-1抑制剂作为食管鳞癌的一线治疗,具有更好的总生存效益。既往RATIONALE-302研究已经证明,替雷利珠单抗用于一线系统性化疗后疾病进展的晚期或转移性食管鳞癌患者,相较于化疗,可延长OS。有基础研究发现,紫杉醇等化疗药物能很好地塑造炎性免疫微环境,促进肿瘤细胞多种促炎细胞因子释放,并在一定程度上激活多个免疫细胞,联合PD-1抑制剂,则可能发挥协同效应5。此次RATIONALE-306研究再次验证了PD-1抑制剂替雷利珠单抗+化疗用于食管鳞癌一线治疗的疗效及安全性。另外,RATIONALE-306是第一项探究PD-1抑制剂联合不同化疗方案的全球性研究,化疗方案的铂类联合氟尿嘧啶或紫杉醇受到国内外多部指南推荐,因此RATIONALE-306的研究设计符合全球真实世界的医疗实践情况。
总体而言,免疫治疗已经成为食管癌治疗的基石,精准免疫治疗是未来食管癌治疗的方向。基于食管癌微环境分子特征设计出更加合理的治疗方案、寻找精确的分子标志物和最佳适用人群是食管癌精准免疫治疗的必由之路5,期待未来有更多的突破引领食管癌精准免疫治疗,为患者带来更多希望。
参考文献
1. Bond MJG, Bolhuis K, Loosveld OJL, et al. First-line systemic treatment strategies in patients with initially unresectable colorectal cancer liver metastases (CAIRO5): an open-label, multicentre, randomised, controlled, phase 3 study from the Dutch Colorectal Cancer Group. Lancet Oncol. 2023 Jul;24(7):757-771.
2. Wang XL,et al. Efficacy and safety of regorafenib plus biweekly TAS-102 for refractory metastatic colorectal cancer (REGTAS): A multicenter single-arm phase II trial. J Clin Oncol 41, 2023 (suppl 16; abstr e15567).
3. Cytryn SL,et al. First-line regorafenib with nivolumab and chemotherapy in advanced oesophageal, gastric, or gastro-oesophageal junction cancer in the USA: a single-arm, single-centre, phase 2 trial. Lancet Oncol. 2023;S1470-2045(23)00358-3.
4. Xu J, Kato K, Raymond E, et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment for advanced or metastatic oesophageal squamous cell carcinoma (RATIONALE-306): a global, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2023 May;24(5):483-495.
5. 焦曦,鲁智豪. 2021年食管癌临床治疗进展. 肿瘤综合治疗电子杂志.2022;8(1):61-71.
