GI医声 第5期 I 消化道肿瘤治疗蓬勃发展,合理联合、剂量优化可实现更佳获益
医脉通 2023.11.24

GI 医声
13条内容

导读:从食管到胃到直肠,消化道肿瘤是中国的高发肿瘤。多数国内患者确诊时已经是中晚期,预后较差。近年来,在全球消化道肿瘤研究者的共同努力下,消化道肿瘤治疗领域取得了突破性进展。分子靶向药物和免疫治疗药物的研发、药物剂量的优化为消化道肿瘤的治疗带来了新的希望。此外,化疗联合靶免治疗的个体化策略也逐渐成为治疗的重要方向。本期GI医声特邀北京医院赵赟愽教授、上海交通大学医学院附属第一人民医院李琦教授、青岛大学附属医院吕静教授、复旦大学附属肿瘤医院王辰辰教授分享消化道肿瘤领域前沿进展,期待为消化道肿瘤的治疗提供新思路。

研究背景
CLDN18.2蛋白是一种高度特异、稳定地表达于多种恶性肿瘤细胞表面的靶点蛋白,与其特异性结合的Zolbetuximab目前已被多项临床试验证实了其较好的疗效及耐受性1,2。CLDN18.2在正常胃细胞中表达,在恶性G/GEJ腺癌细胞中也有表达。对于人表皮生长因子受体2(HER2)阴性的不可切除局部晚期或转移性胃/胃食管交界处腺癌(GA/GEJA)患者,迫切需要一线治疗方案。2023年7月31日,III期GLOW研究成果发表于全球著名医学期刊Nature Medicine杂志(最新IF=82.9)1。
研究设计
GLOW是一项全球性随机双盲3期研究,纳入了507例既往未经治疗的CLDN18.2阳性/HER2阴性不可切除局部晚期或转移性GA/GEJA患者,按1:1随机分配至Zolbetuximab+CAPOX组(254例)或安慰剂+CAPOX组(253例)。主要终点为独立审查委员会(IRC)基于RECIST v1.1评估的无进展生存期(PFS);关键次要终点为总生存期(OS);其他次要终点包括客观缓解率(ORR)、缓解持续时间(DoR)和安全性等。
研究结果
相较于安慰剂+CAPOX组,Zolbetuximab+CAPOX组的中位PFS(8.21个月vs 6.80个月)和中位OS(14.39个月vs 12.16个月)均显著延长,疾病进展风险降低了31.3%[风险比(HR)=0.687,95%可信区间(CI):0.544-0.866,P=0.0007],死亡风险降低了22.9%(HR=0.771,95%CI:0.615-0.965,P=0.0118)。多数关键亚组(无论患者年龄、性别、地区、转移部位、手术背景、Lauren分型等)均可从Zolbetuximab+CAPOX治疗中获益。
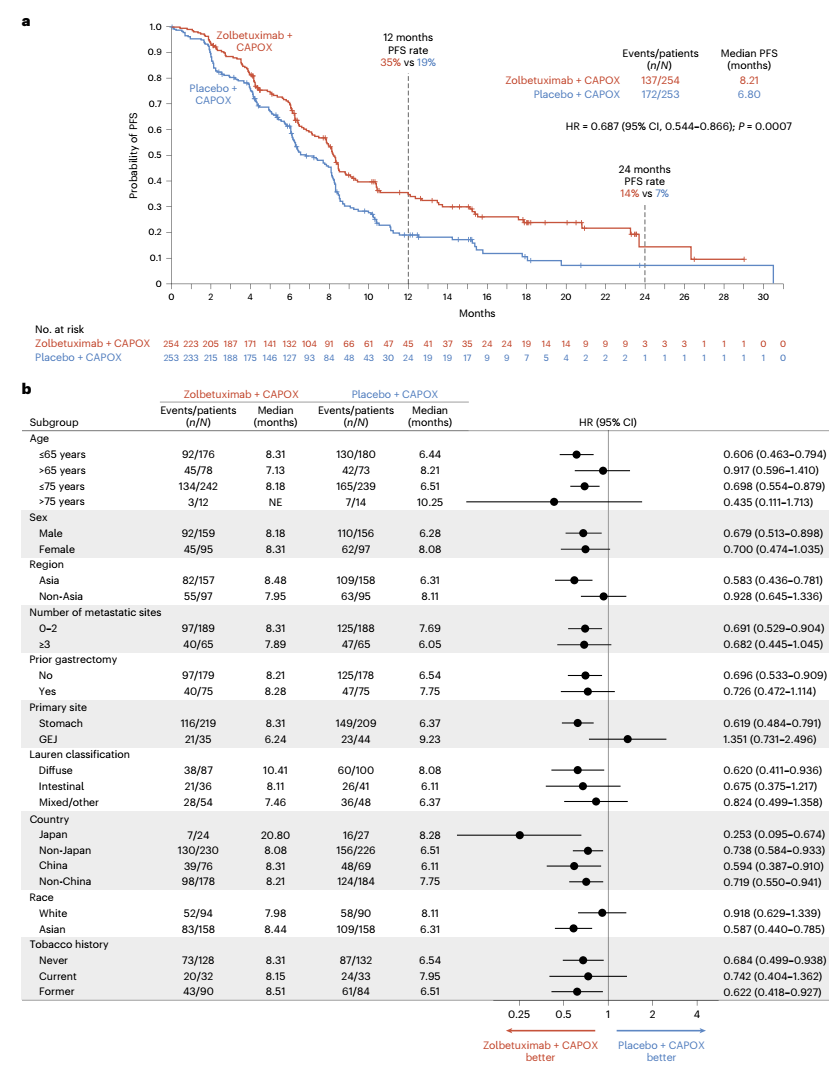
图1 GLOW研究ITT人群PFS曲线图及PFS亚组分析
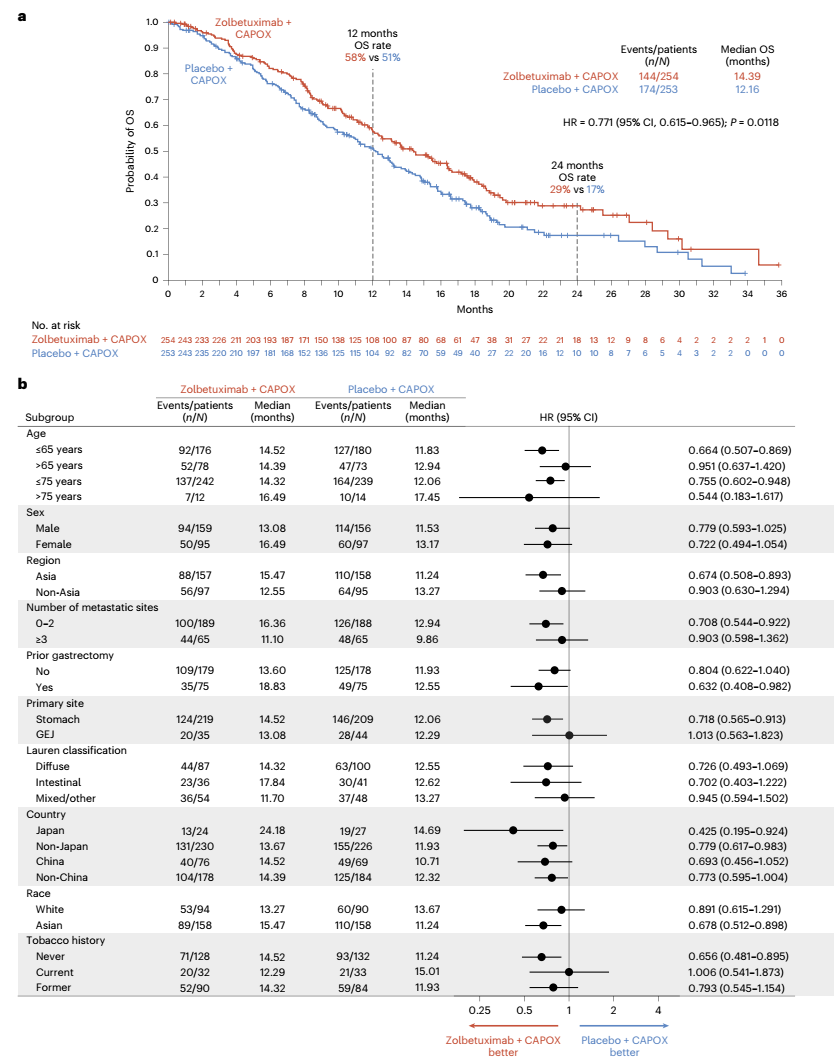
图2 GLOW研究ITT人群OS曲线图及OS亚组分析
此外,在可测量病灶中,Zolbetuximab+CAPOX组和安慰剂+CAPOX组的ORR分别为53.8% vs 48.8%。
安全性方面,Zolbetuximab+CAPOX组与安慰剂+CAPOX组在治疗期间最常见的不良事件(TEAEs)包括恶心(68.5% vs 50.2%)、呕吐(66.1% vs 30.9%)和食欲下降(41.3% vs 33.7%);≥3级TEAEs发生率分别为72.8%和69.9%。Zolbetuximab+CAPOX组安全性总体可控可管理。
研究结论
Zolbetuximab联合CAPOX一线治疗CLDN18.2阳性/HER2阴性的不可切除局部晚期或转移性GA/GEJA可显著延长患者PFS和OS,是患者潜在的一线治疗选择。
专家锐评

胃癌在 2020 年全球恶性肿瘤发病率中排第5位,全球范围内每年有110万新发病例,76.8万死亡病例,其中中国患者人数居全球首位,晚期胃癌患者5年生存率仅6%。
曲妥珠单抗被批准用于HER2阳性GA/GEJA患者的一线治疗,但HER2阳性患者占比约12-18%,更多患者为HER2阴性人群。HER2阴性患者的标准一线治疗为铂类+氟嘧啶类化疗,但OS通常仅为1年。近年来的研究进展使化疗联合PD-1单抗成为该类晚期患者一线的新选择,但这一治疗模式在PD-L1低表达人群中的疗效尚存在争议。因此,对于HER2阴性人群,仍存在巨大的未被满足的治疗需求。
CLDN18.2蛋白是近年来新发现的一种跨膜蛋白,具有高选择性特点,稳定地过表达于多种恶性肿瘤,在胃癌/胃食管结合部癌中,高达60%的患者可以检测到CLDN18.2的高表达。其中CLDN18.2阳性定义为大于75%的肿瘤细胞对CLDN18.2呈中高强度染色,不同地区的CLDN8.2表达不一致,中国大陆地区CLDN8.2阳性表达率约35%。因此CLDN18.2成为了近几年抗肿瘤药物分子靶点研究的热点,在胃癌患者中,CLDN8.2高表达者多为女性、白种人、年轻人,病理类型多为弥漫型且伴腹膜转移,CLDN18.2表达与肿瘤类型(胃/胃食管结合部)、肿瘤部位(胃近端/远端)、样本采集方式(活检/切除)、采集部位(原发灶/转移灶)无关。其特异性抗体 Zolbetuximab是一种靶向CLDN18.2的嵌合IgG1单克隆抗体,通过与胃癌细胞表面的CLDN18.2结合,依靠ADCC和CDC诱导癌细胞凋亡。在治疗CLDN18.2阳性/HER2阴性的不可切除局部晚期或转移性GA/GEJA患者更是具有潜力。
既往研究发现,以Zolbetuximab为代表的CLDN18.2靶向药物能有效地杀伤CLDN18.2阳性细胞,包括体外或体内人类胃癌细胞株2。在今年ASCO-GI上,Ⅲ期SPOTLIGHT研究发布,Zolbetuximab+mFOLFOX6取得了PFS(10.61月vs 8.67月)和OS(18.23月vs15.54月)延长,将疾病进展和死亡风险降低了25%,亚组分析不论PFS还是OS,亚洲人群获益高于于非亚洲人群,既往手术切除者高于未经手术者,肠型患者高于弥漫型和混合型。GLOW研究选择了Zolbetuximab+CAPOX的化疗组合,使PFS延长了1.41个月,疾病进展风险降低了31.3%,OS延长了2.23个月,疾病死亡风险降低了22.1%。ORR从48.8%提高至53.8%,其中中国患者入组145名,研究中心的1/4来自于中国,中国在该研究中占主导地位。安全性方面主要以恶心、呕吐和食欲下降为主,分析消化道反应显著的原因,可能与CLDN18.2主要位于胃黏膜有关,在全胃切除患者中相对较轻。GLOW研究的成功标志着胃癌治疗的格局将发生重大改变,为胃癌患者提供了新的治疗标准。既丰富了治疗选择,又很好地满足了患者需求。Zolbetuximab的获益人群筛选、新的联合治疗方案将是未来的重要探索方向。
总之,相信“以患者利益为中心,以临床价值为导向”的新药研发,会不断推进肿瘤诊治向前发展,随着靶向药物研究的不断进展,新靶向药物的诞生会为恶性肿瘤的诊治带来新的希望,期待这些研究成果使更多患者收益!

研究背景
对于可切除的胃/食管胃交界处(G/GEJ)腺癌患者,手术联合围手术期铂类化疗是标准治疗方案。然而,对于伴有错配修复缺陷(dMMR)/高度微卫星不稳定性(MSI-H)的G/GEJ腺癌患者,能否从围手术期化疗中获益尚存在争议。既往研究显示,围术期免疫治疗或可改善dMMR/MSI-H癌症患者预后,因此,对这类人群进行了围手术期免疫治疗替代化疗的探索。2023年1月, Journal of clinical oncology(JCO)发表GERCOR NEONIPIGA II期研究结果,旨在探索纳武利尤单抗联合伊匹木单抗新辅助治疗后使用纳武利尤单抗辅助治疗对于dMMR/MSI-H可切除G/GEJ腺癌患者的有效性和安全性4。
研究方法
NEONIPIGA研究是一项来自法国的、单臂、多中心II期临床研究,纳入32例可切除的局部晚期dMMR/MSI-H、cT2-T4NxM0 G/GEJ腺癌患者,接受新辅助纳武利尤单抗(240mg,Q2W×6)联合伊匹木单抗(1mg/kg,Q6W×2 [第1周期和第4周期])治疗,新辅助治疗结束后5(±1)周行手术治疗,术后4-8周接受辅助纳武利尤单抗(480mg,Q4W×9)治疗。中位随访时间为14.9个月(数据截止日期为2020年2月28日)。主要研究终点是病理完全缓解率(pCR)。
研究结果
新辅助治疗
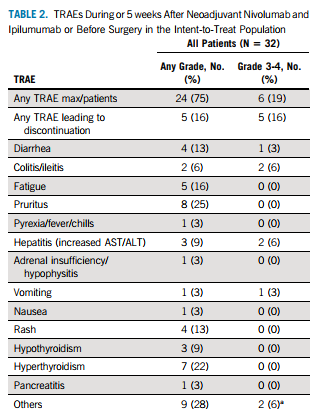
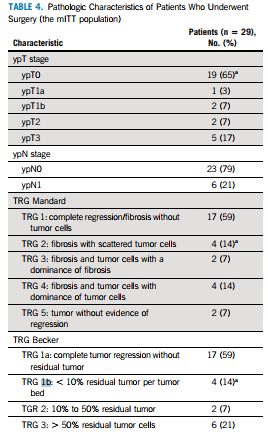
32例患者接受了纳武利尤单抗+伊匹木单抗新辅助治疗。27例(84%)患者完成所有治疗周期。在术前和新辅助治疗后进行RECIST v1.1评估,5例患者达到完全缓解(CR), 12例达到部分缓解(PR),11例疾病稳定(SD),4例无法评估。6例(19%)患者经历了3/4级治疗相关不良事件(TRAEs)。
表1 新辅助治疗5周后或手术治疗前TRAEs
手术治疗
29例(91%)患者接受R0切除手术,其中17例(58.6%)患者实现pCR。3例未接受手术的患者(2例拒绝手术,1例在纳入时有转移)通过内镜检查和计算机断层扫描显示完全缓解。手术并发症发生率为55%。
表2 手术类型和手术并发症发生率
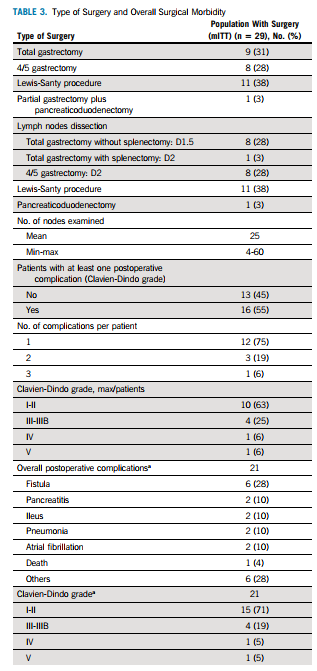
表3 手术患者病理特征
辅助治疗
在29例手术患者中,23例(79%)接受了纳武利尤单抗辅助治疗。其中,5例患者因TRAE停止治疗,3例患者根据研究者的决定停止治疗。9例患者接受了所有9个周期的辅助治疗,6例在数据截止时仍在接受治疗。
EFS(无事件生存期)和OS(总生存期)
对31例患者进行生存分析(排除1例转移性患者),结果显示在数据截止日期,97%(30例)的患者存活且无复发或进展,1例患者术后3天死亡。入组时有转移性疾病的1例患者经9.4个月随访,在数据截止时无事件发生。
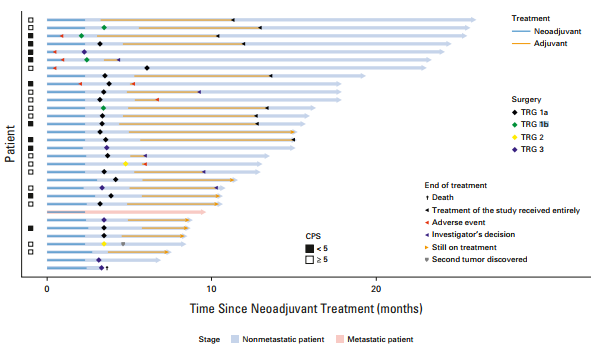
图1 每例患者的CPS、治疗持续时间和Becker TRG分级
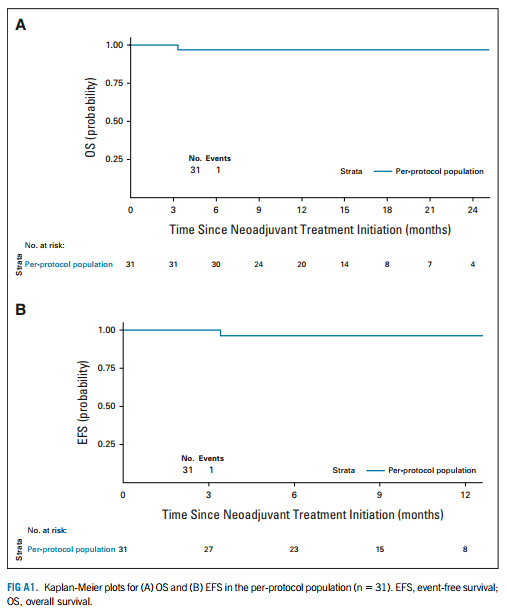
图2 患者OS(A)和EFS(B)数据
研究结论
纳武利尤单抗和伊匹木单抗为基础的新辅助治疗对dMMR/MSI-H可切除G/GEJ腺癌患者是可行的,可获得较高的pCR率高且无严重意外毒性反应。
专家锐评

对于局部晚期dMMR/MSI-H型G/GEJ腺癌患者,使用新辅助/辅助化疗的主要存在两项争议:首先,尽管dMMR/MSI-H型肿瘤预后良好,但使用基于铂类和氟嘧啶为基础的新辅助化疗pCR率较低,仅为3%-11%。其次,新辅助/辅助化疗是否能够带来这部分患者的总生存获益尚不明确。在此背景下,研究者对dMMR/MSI-H型G/GEJ腺癌患者进行了围手术期免疫治疗的探索。GERCOR NEONIPIGA II期研究首次使用纳武利尤单抗和伊匹木单抗免疫治疗方案对dMMR/MSI-H可切除G/GEJ腺癌进行围手术期治疗,其结果令人鼓舞,pCR率高达58.6%。此外,NEONIPIGA研究中,3例未行手术的患者新辅助免疫治疗治疗后实现完全缓解,这表明纳武利尤单抗联合伊匹木单抗可探索作为dMMR/MSI-H型G/GEJ腺癌患者的手术替代方案。虽然GERCOR NEONIPIGA研究目前还没有改变临床实践,但这些发现为其他研究改变这类患者的标准治疗铺平了道路。
该研究也存在一些不足之处,该研究为非随机对照研究,入组患者数较少,且患者生存获益有待于进一步随访确认。因此,对此研究结论的解读需要谨慎,未来需要更多的研究来验证这些结果。

研究背景
目前,高危的局部晚期直肠癌(LARC)患者通常接受全程新辅助治疗(TNT)后再行手术。既往SAKK 41/08研究表明,在长程放化疗(LcCRT)中加用索拉非尼具有高度抗肿瘤活性5-7。RECAP研究8旨在探讨多靶点TKI瑞戈非尼联合LcCRT方案新辅助治疗对局部晚期直肠癌临床结局的潜在改善作用。该研究结果于2022年ESMO公布。
研究设计
RECAP研究纳入了25例T3-4和/或N+M0且二氢嘧啶脱氢酶(DYPD)野生型患者。新辅助LcCRT:卡培他滨825 mg/m2,d1-38;放疗28次,每次1.8Gy(共50.4Gy);瑞戈非尼d1-14和d22-35。第一阶段对瑞戈非尼采用“3+3”剂量递增(DE)方案,推荐剂量(RD)用于剂量扩展(CE)阶段。CE阶段的主要终点包括剂量限制毒性(DLT)和病理反应(根据Dworak分级定义为接近完全缓解[npCR]或完全缓解[pCR])。
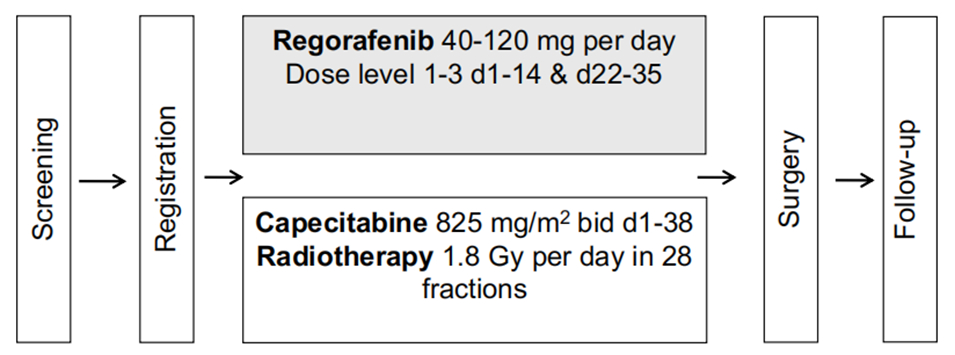
图1. RECAP研究设计
研究结果
主要终点
中位放疗剂量为50.4Gy。2例患者在接受瑞戈非尼120 mg治疗时出现DLT,减少剂量至80 mg。19例患者接受了RD治疗,其中8例(42.1%;单侧80%CI[下限]:30.7%;95%CI:20.3%-66.5%)达到了主要终点(5例[26.3%]达到npCR,3例[15.8%]达到pCR)。

图2. RECAP研究DLT结果
手术治疗结局
25例患者中,24例接受了手术治疗,其中18例行全直肠系膜切除术(TME),5例行经腹会阴联合切除术(APR)。1例患者因达到临床CR(cCR)未接受手术治疗。所有患者均为R0切除,且边缘清晰。CE队列(n=19)纳入了6例DE队列患者,18例接受了手术治疗,其中15例(83.3%)出现T和/或N分期下降。
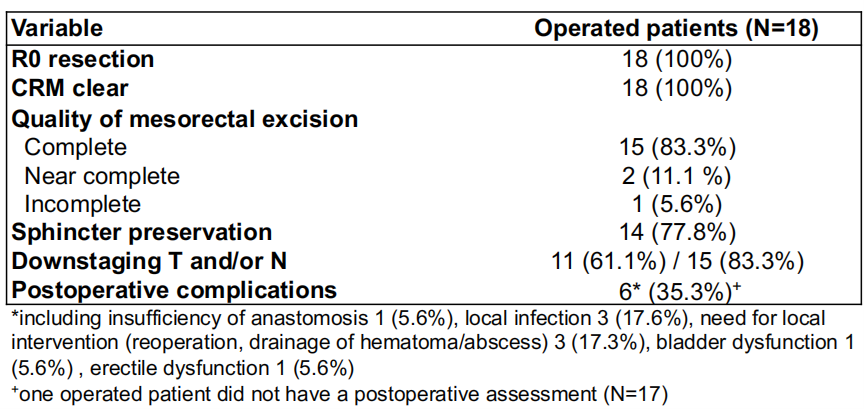
图3. RECAP研究手术患者结局
术后并发症
接受瑞戈非尼治疗的患者中未观察到4/5级治疗相关不良事件。6例(35.3%)发生了术后并发症,1例发生G4级吻合口瘘,3例发生局部感染。CE队列中最常见的治疗相关不良事件G3为腹泻和直肠吻合口瘘,各有2例。术后并发症与预期一致。
研究结论
总体而言,在局部晚期直肠癌中,瑞戈非尼80 mg联合长程放化疗在剂量扩展阶段达到了主要终点,表现出较强的抗肿瘤活性,且相较TNT方案,该方案未延长新辅助治疗时间,安全可控,术后并发症与预期一致。该方案值得进一步研究,以评估其与TNT方案的疗效对比。
专家锐评

术前放化疗目前是LARC的标准治疗策略,既往多项研究显示,该方案可改善转归,但其对于无病生存期(DFS)与总生存期(OS)的改善有限。研究表明,有cT4a、cT4b、cN2、壁外血管侵犯(EMVI)阳性、系膜筋膜(MRF)阳性及侧方淋巴结阳性等因素的LARC患者,具有较高的复发转移风险。针对这部分高危患者,可采用3种强化治疗方案以提高疗效:增加新辅助放疗剂量、增加新辅助化疗强度(包括应用两药联合化疗或增加化疗周期数)、采用TNT治疗模式。其中,TNT治疗模式是将术后辅助化疗提前到新辅助治疗阶段,相较标准治疗模式可更早给予患者系统化疗,更大程度争取肿瘤退缩,从而尽可能提高放化疗的有效性。
随着医学的不断探索,研究者们发现,多靶点TKI联合放化疗新辅助治疗或能成为LARC患者新的治疗策略。既往SAKK 41/08研究表明,索拉非尼联合长程放化疗方案新辅助治疗的npCR与pCR率分别为45%与15%,且其安全可控。瑞戈非尼作为一种多靶点TKI,基础研究已证实其具有放疗增敏作用以及诱导细胞凋亡作用,而且瑞戈非尼也已在晚期结直肠癌的治疗中显示出优异疗效。2022ESMO年会发布的RECAP研究结果显示,瑞戈非尼联合长程放化疗方案表现出了较强的抗肿瘤活性,同时,该方案安全可控,并未增加新辅助治疗时间与围手术期并发症。因此,瑞戈非尼联合长程放化疗或可成为局部晚期直肠癌新辅助治疗探索的新方向。

研究背景
瑞戈非尼是一种口服的多靶点小分子酪氨酸激酶抑制剂,可通过有效阻断VEGFR1-3、TIE2、RET、RAF1、KIT、BRAF、PDGFR和FGFR等多个蛋白激酶而发挥抗血管生成、抗肿瘤形成和改变肿瘤免疫微环境等功能。然而,瑞戈非尼的治疗起始剂量在临床中一直存在争议。2023年,一项日本发表的“瑞戈非尼治疗晚期不可切除转移性结直肠癌的 II 期剂量滴定研究”再次为瑞戈非尼提供了剂量优化策略9。
研究设计
REGOCC-12是一项多中心、单臂、开放标签、II 期探索性研究,旨在探索瑞戈非尼起始剂量120 mg的有效性和安全性。患者采用瑞戈非尼120 mg/d,给药3周/停药1周方案治疗。研究的主要终点为研究者评估的的疾病控制率(DCR),次要终点包括无进展生存期(PFS)、总生存期(OS)、客观缓解率(ORR)、治疗持续时间和安全性。
研究结果
2015年9月至2017年3月,共有60例患者入组并登记。研究中,第1周期6例患者、第2周期15例患者、第3周期1例患者、第5周期1例患者瑞戈非尼用药剂量从120mg减少至80mg;1例患者从第3周期至第10周期用药剂量减少至40mg;2例患者剂量增加至160mg。
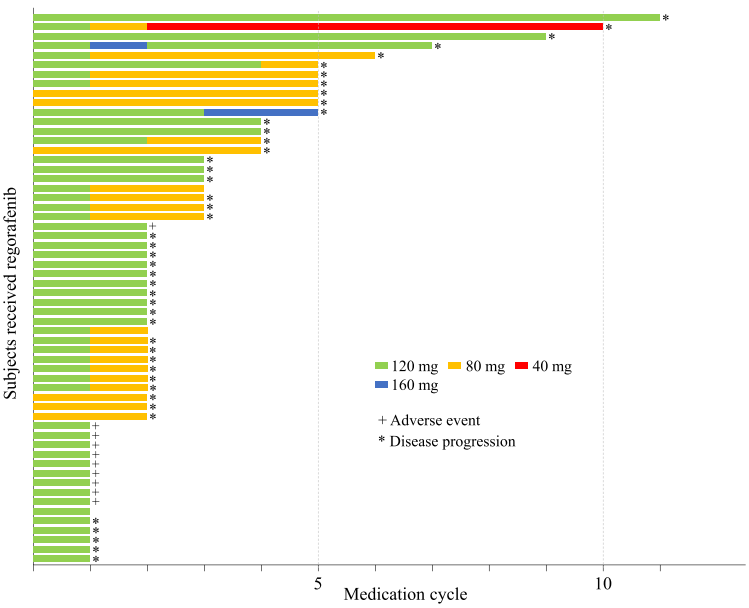
图1 患者采用瑞戈非尼的用药史游泳图
分别有23例(38.3%)和 36例(60%)患者观察到SD和PD,1 例(1.7%)患者无法评估疗效。数据显示,主要终点DCR为38.3%(90%CI 28.0–48.7),次要终点中位PFS为 2.5个月(95%CI 1.9-3.7),中位OS为 10.0个月(95%CI 6.9-15.2)。
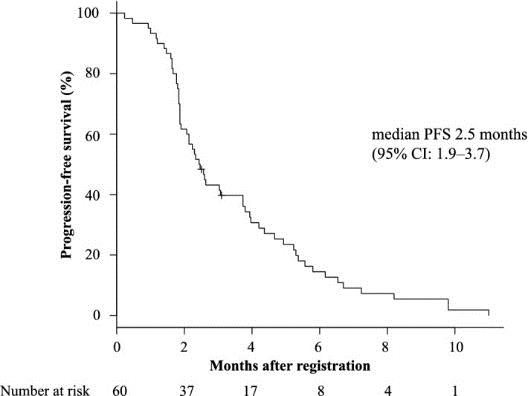
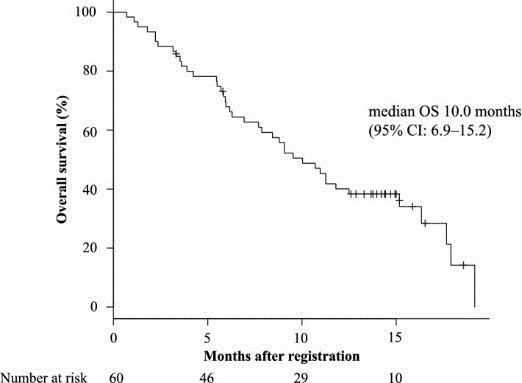
图2 研究的PFS和OS结果
另外,研究的12个月生存率为40.0%(95% CI 27.5-52.3)。RAS野生型和突变型患者的中位OS分别为11.3个月和10.7个月(p=0.504)。
安全性方面,瑞戈非尼常见的3-4级不良事件为手足皮肤反应(20.0%)和高血压(20.0%)。
表1 治疗期间出现的不良事件
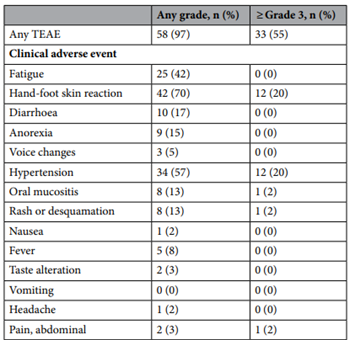
研究结论
瑞戈非尼每天120 mg起始剂量的给药结果与既往 III 期试验(使用的起始剂量为 160 mg)的报告一致。
专家锐评

结直肠癌发病率高,死亡率高。据统计,大约25%的患者在诊断之初就伴有不同部位的转移,超过50%的患者最终会发展为转移性结直肠癌。在瑞戈非尼出现之前,转移性结直肠癌患者后线选择的方案十分有限。瑞戈非尼的上市打破了治疗僵局,其具有作用靶点多、疗效及耐受性良好、用药便利等多个优点而得以在临床上广泛使用。
然而,“剑有双刃”。在临床研究及真实世界应用中,部分患者因不良反应需调整瑞戈非尼的剂量9,10。因此,优化剂量、更好地管理不良反应是目前瑞戈非尼临床研究的重点之一。现今,国际上已有多个研究对瑞戈非尼起始剂量及给药模式进行了探讨。
其中,2023ASCO会议上发表的“塞来昔布对结直肠癌肝转移患者瑞戈非尼相关手足综合征的预防效果:一项单中心、回顾性、真实世界研究”提示,联合应用塞来昔布具有降低瑞戈非尼严重HFS的趋势,并且不会缩短患者的生存期。
REGOCC-12研究则是一项针对亚洲人群用药剂量的探索。结果表明,瑞戈非尼治疗经标准方案失败的晚期结直肠癌取得了良好的生存获益,中位OS达到了10.0个月,12个月生存率为40.0%,超过了CORRECT 研究中的 24.3%。提示了以120 mg 为起始剂量的患者,仍有可能获得与以160 mg 为起始剂量患者相似的 DCR。综合考虑,120 mg具有相对较好的风险/获益比,是比较适合亚洲患者的起始剂量。这一研究结果与既往研究结果较为一致,包括瑞戈非尼治疗难治性转移性结直肠癌的一项多中心回顾性研究(120mg终末剂量组中位PFS和OS优于≤80mg终末剂量组),以及中国医学科学院肿瘤医院周爱萍教授团队的真实世界研究(相较于最终日剂量80 mg和160 mg,起始剂量120 mg的瑞戈非尼具有较好的风险/获益比,较为适合晚期结直肠癌患者)。
综上所述,REGOCC-12研究为晚期结直肠癌患者采用瑞戈非尼用药决策提供了参考依据。
参考文献
1. Shah MA, Shitara K, Ajani JA,et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023 Aug;29(8):2133-2141.
2. 徐良额,何天阳,张丽,等. CLDN18.2 蛋白在恶性肿瘤治疗中的研究进展. 中国肿瘤临床.2019;46(6):311-315.
3. 王雨芊,陈亚玫,杨洁,等. 分析鉴定胃食管交界处腺癌发生与进展的关键基因. 基础医学与临床.2021;41(6):831-836.
4. André T,et al. Neoadjuvant Nivolumab Plus Ipilimumab and Adjuvant Nivolumab in Localized Deficient Mismatch Repair/Microsatellite Instability-High Gastric or Esophagogastric Junction Adenocarcinoma: The GERCOR NEONIPIGA Phase II Study. J Clin Oncol. 2023;41(2):255-265.
5. R. von Moos et al, Neoadjuvant radiotherapy combined with capecitabine and sorafenib in patients with advanced KRAS-mutated rectal cancer: A phase I/II trial (SAKK 41/08) Cancer, 2018 Jan;89:82-89
6. R.Bahadoer et al. Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial Lancet Oncol 2021; 22: 29–42
7. T. Conroy et al., Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, openlabel, phase 3 trial; Lancet Oncol. 2021 May;22(5):702-715.
8. S. Bastian, M. Joerger, D. Baertschi, et al. Neoadjuvant treatment with regorafenib and capecitabine combined with radiotherapy in locally advanced rectal cancer: A multicenter phase Ib trial (RECAP) SAKK 41/16. 2022ESMO Abstract 431p.
9. Kato T, Kudo T, Kagawa Y, et al. Phase II dose titration study of regorafenib in progressive unresectable metastatic colorectal cancer. Sci Rep. 2023 Feb 9;13(1):2331.
10. 姜志超,孙永琨,张雯,等. 瑞戈非尼治疗晚期结直肠癌患者真实世界数据分析. 中华医学杂志.2020(26):2018-2022.
