GI医声 第6期 I 砥砺前行,专属定制,消化道肿瘤特殊人群迎来“量身打造”新方案
医脉通 2023.11.30

GI 医声
13条内容

导读:近年来,一系列研究在消化道肿瘤治疗中取得了重要的突破。其中,化疗方案的改良和联合策略助力结直肠癌更长生存获益。新型抗体偶联药物(ADC)的探索也开启了晚期胃癌治疗新格局。这些研究的成果为消化道肿瘤治疗带来了新的希望和进展,为临床实践提供了重要的指导。本期GI医声特邀哈尔滨医科大学附属肿瘤医院王广雨教授、河南省人民医院贾刚教授、宁波市第二医院张琛教授、南京医科大学附属苏州医院国风教授分享消化道肿瘤领域前沿进展,期待为消化道肿瘤的治疗提供新思路。

研究背景
结直肠癌(CRC)是我国最常见的癌症类型之一,至今仍是导致癌症相关死亡的主要原因。一项来自中国的多中心回顾性研究显示,近一半的转移性CRC(mCRC)患者年龄在60岁及以上,而老年患者具有发病率更高的严重并发症、更低的骨髓再生能力以及更差的一般体能状态等特点。瑞戈非尼是一种口服小分子多靶点激酶抑制剂,国内外权威指南已经推荐其为mCRC的三线标准治疗。最近的数据表明,瑞戈非尼联合免疫检查点抑制剂可提高mCRC患者的生存期。REGONIVO研究中,mCRC患者经瑞戈非尼联合PD-1抑制剂治疗的客观缓解率(ORR)为33%,中位无进展生存期(PFS)为7.9个月。后续国内的REGOTORI研究ORR为15.2%,中位总生存期(OS)为15.5个月。然而,这一治疗策略应用于中国老年mCRC患者的疗效有待进一步研究。本项真实世界研究首次探索了瑞戈非尼联合PD-1抑制剂治疗中国老年mCRC的治疗模式、临床结局和预后因素1。
研究设计
本研究回顾性分析了2019年1月至2021年1月在河南省肿瘤医院接受瑞戈非尼联合PD-1抑制剂治疗的mCRC患者数据,入组患者年龄≥60岁,共计纳入24例患者,中位年龄为68岁,62.5%为女性。研究终点包括OS、PFS和预后因素。
研究结果
OS、PFS数据
中位OS和中位PFS分别为15.03个月(95%CI:7.0-23.0)和4.0个月(95%CI:1.8-6.2)。
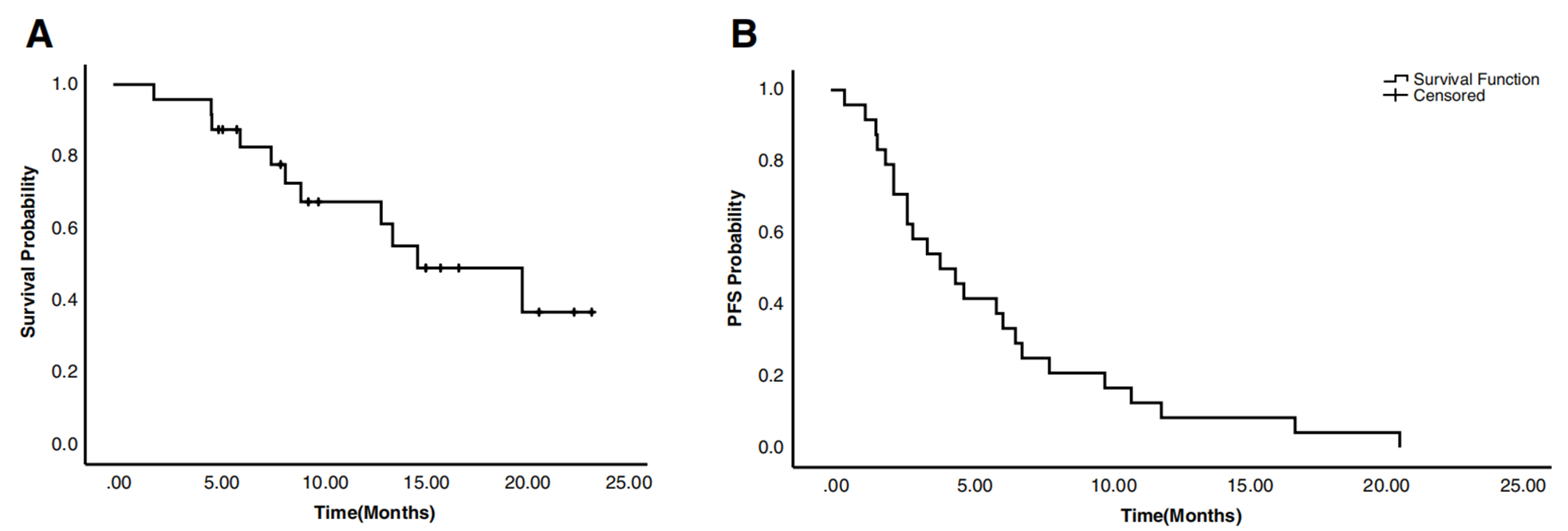
图1 OS、PFS数据
ORR、DCR数据
ORR为8.3%(2/24例),均为部分缓解(PR);15/24例获得疾病稳定(SD);疾病控制率(DCR)为70.8%(17/24例)。
与瑞戈非尼暴露相关的结果
联合治疗前接受过瑞戈非尼单药治疗的患者的中位PFS较未接受治疗的患者更长(6.3个月 vs 2.8个月)。在每日剂量方面,高剂量组(瑞戈非尼每日剂量>80 mg)的PFS相较低剂量组(瑞戈非尼每日剂量≤80 mg)具有更好的趋势(两组中位PFS分别为10.0个月和3.5个月)。
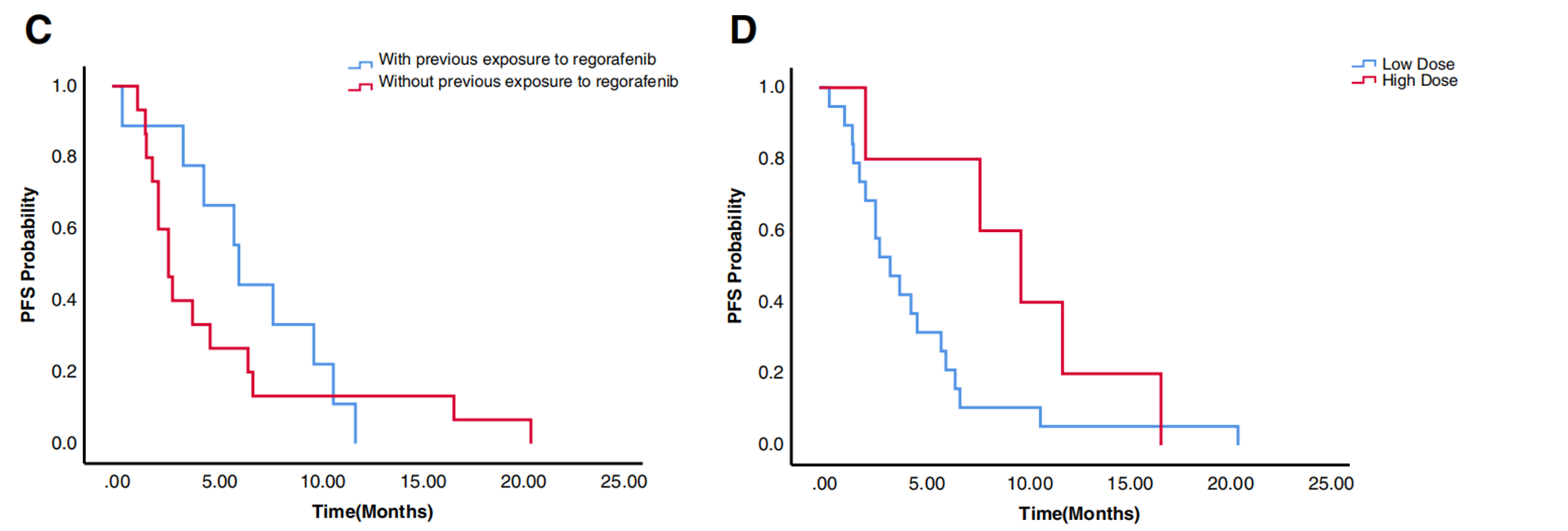
图2 既往是否暴露过瑞戈非尼的PFS数据、高剂量组和低剂量组的PFS数据
研究结论
这一真实世界研究证实,中国老年mCRC患者可能从瑞戈非尼联合PD-1抑制剂治疗中获益,这与所有年龄段患者的联合治疗策略类似。
专家锐评

由于95%的CRC病例表现出微卫星稳定/错配修复正常(MSS/pMMR)特征,探索适应性免疫或联合方案在MSS CRC患者中的临床应用尤为重要。多项研究表明,瑞戈非尼与PD-1抑制剂的联合治疗方案对这部分患者具有良好疗效,例如,REGONIVO研究的最高ORR为33%,REGOTORI研究的中位OS长达15.5个月。本项研究首次提供了该联合治疗方案在中国老年mCRC患者中的真实世界疗效证据。
本项研究入组患者的中位年龄为68岁,较大多数使用瑞戈非尼或瑞戈非尼联合PD-1抑制剂的相关研究纳入患者的中位年龄(53.0岁-61.3岁)更大,最终,本研究报告的中位OS达到了15.03个月。不仅如此,对于mCRC患者,本研究中瑞戈非尼联合PD-1抑制剂治疗的患者ORR为8.3%,同时有70.8%的患者实现疾病控制。这些数据均表明,瑞戈非尼联合PD-1抑制剂值得推荐用于老年mCRC患者,尤其是具有MSS/pMMR型的患者。
另外,2023年ASCO大会上发布的一项研究显示,瑞戈非尼联合塞来昔布方案为结直肠癌肝转移患者带来了显著的ORR获益,并降低3级手足综合征的发生率为0,明显改善瑞戈非尼耐受性。这项研究为mCRC患者的治疗打开了新思路,联用塞来昔布或可保障使用瑞戈非尼治疗的患者的安全性,降低严重手足综合征发生率。
值得注意的是,本研究结果还提示,在联合用药前先使用瑞戈非尼单药治疗可能会增加PFS获益。这可能与瑞戈非尼可通过抑制VEGFR、CSF-1R、RET等靶点,使血管正常化,将免疫抑制的肿瘤微环境重新调整为免疫支持的肿瘤微环境,进而增强免疫治疗效果相关。但是否能转化为OS获益,需要在更大规模的研究中进一步证实。
最后,由于本研究的样本量有限,瑞戈非尼联合PD-1抑制剂的联合治疗模式仍需要更大样本的数据和更高级别的循证医学证据,尽早使该方案惠及更多老年CRC患者。

研究背景
结直肠癌是最常见的恶性肿瘤之一,发病率呈逐年上升趋势。肝脏是结直肠癌最常见的转移部位,结直肠癌肝转移(CRLM)是死亡的主要原因。不可切除CRLM患者的5年生存率低于5%。许多CRLM患者在标准一线/二线治疗失败后亟需有效的后续治疗。2022年12月,Journal of Oncology发表一项研究,旨在探索TACE联合瑞戈非尼相比单独TACE三线治疗CRLM患者的有效性和安全性。
研究设计
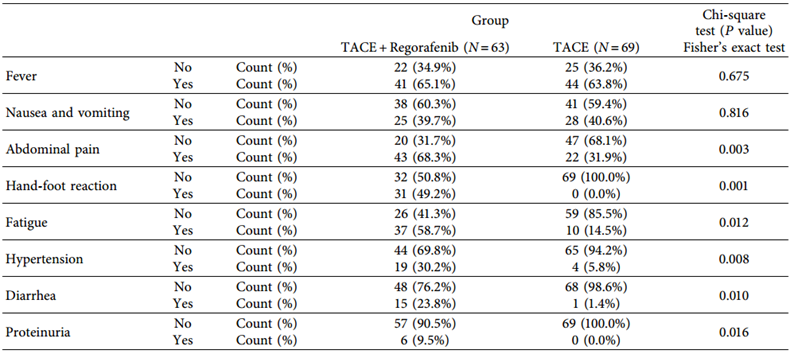
本研究是一项单中心回顾性研究。收集2016年1月至2019年12月华中科技大学同济医学院附属协和医院介入科的132例CRLM患者的临床资料。患者被分为两组:瑞戈非尼+TACE组(N=63);TACE组(N=69)。TACE使用CalliSpheres®载药微球(负载伊立替康)。瑞戈非尼的剂量为120mg每日一次,用药3周停药1周,如果由于药物不良反应导致患者严重无法忍受,剂量调整为80mg每日一次。主要研究终点两组患者的肿瘤反应、客观缓解率(ORR)、疾病控制率(DCR)、总生存期(OS)和无进展生存期(PFS)。
研究结果
两组患者治疗前的基线特征数据无显著差异(表1)。两组治疗后肿瘤反应、ORR、DCR、OS、PFS比较,差异均有统计学意义。TACE联合瑞戈非尼组与TACE组比较:ORR (57.1% vs 33.3%)、DCR (82.5% vs 68.1%)、mOS(18.2个月vs 11.3个月)和mPFS(8.9个月vs 5.3个月)(表2,图1)。
表1 治疗前基线情况
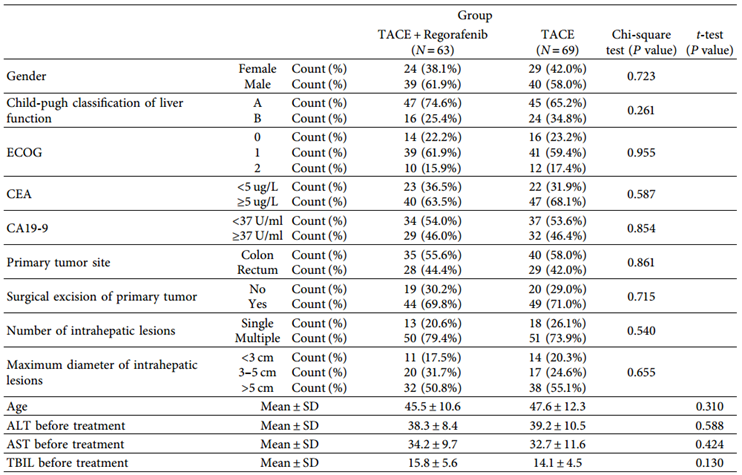
表2 两组治疗后肿瘤反应
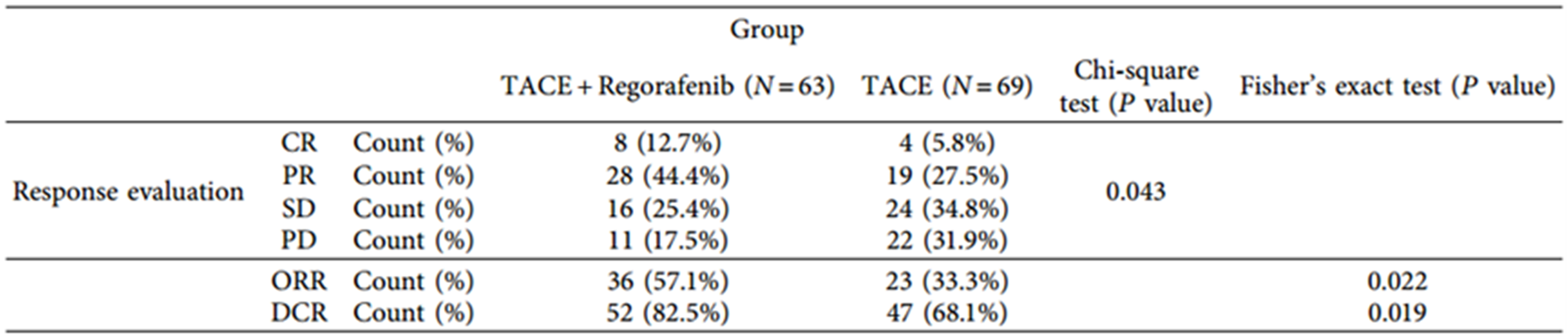
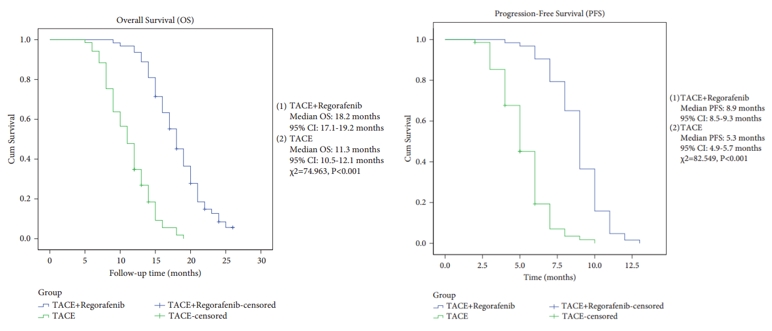
图1 两组患者的OS和PFS情况
此外, TACE +瑞戈非尼组治疗后癌胚抗原(CEA)、癌抗原19-9(CA19-9) 阴性率高于TACE组(P < 0.05)。TACE +瑞戈非尼组治疗后体能状况优于TACE组(P < 0.05)(表4)。虽然TACE+瑞戈非尼联合组不良反应稍多,但不良反应轻微,患者可耐受(表5)。
表4 两组患者治疗后体能状况
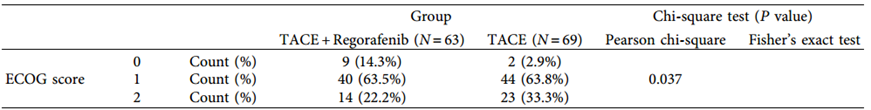
表5 两组患者治疗后不良事件发生率
研究结论
对于CRLM的三线治疗,TACE+瑞戈非尼联合治疗的肿瘤反应、OS和PFS均优于TACE。对于一线和二线标准治疗失败的CRLM患者,TACE+瑞戈非尼联合治疗可被考虑作为挽救性治疗。
专家锐评

肝脏是结直肠癌血行转移最主要的靶器官,CRLM是结直肠癌治疗的重点和难点之一。有研究报道,约50%的结直肠癌患者在病程中可能发生肝转移。肝转移也是结直肠癌患者最主要的死亡原因。当结直肠患者出现肝转移时,仅10-20%的患者可以接受根治性手术治疗,其5年生存率约为35-55%。而对于无法切除的CRLM患者,5年生存率低于5%2,3。
对于不可切除的CRLM患者,5FU(或卡培他滨)联合奥沙利铂和/或伊立替康联合靶向药物的二药或三药化疗方案是标准的一线和二线治疗方案,可显著改善患者预后。然而许多CRLM患者在一线/二线治疗后仍出现肝内疾病进展,需要有效的后续治疗。该研究发现,DEB-TACE+瑞戈非尼三线治疗CRLM患者的肿瘤疗效评价优于DEB-TACE。DEB-TACE+瑞戈非尼组的OS 较DEB-TACE组显著延长(mOS 18.2个月vs 11.3个月,P < 0.05)。同时,DEB-TACE+瑞戈非尼组的PFS较DEB-TACE组显著延长(mPFS 8.9个月vs 5.3个月,P < 0.05)。原因可能是DEB-TACE与瑞戈非尼联合治疗具有协同互补的作用。DEB-TACE治疗后VEGF水平升高,瑞戈非尼的抗血管生成作用弥补了这一不足,延长了化疗栓塞时间,抑制肿瘤的复发和转移;同时,瑞戈非尼可通过多种途径抑制肿瘤细胞增殖。此外, TACE与瑞戈非尼合用是否会增加患者的不良反应,是很多学者关注的问题。该研究显示瑞戈非尼联合TACE治疗安全性良好,栓塞后综合征在患者中可耐受。TACE+瑞戈非尼组患者有更好的体能状况和生活质量。
该研究也存在局限性:1)首先,研究如果能同时设置“瑞戈非尼”单药治疗组作为对照组,或许更能说明二者的协同作用,为晚期肿瘤系统性治疗和局部治疗联合提供更多、更充分依据;2)其次,研究为单中心回顾性研究,样本量有限,未来可开展多中心、大样本的前瞻性研究进行进一步验证这些研究结果,为临床工作提供更多帮助。

研究背景
PROSPECT研究结果在2023年ASCO大会上以口头报告形式公布,并发表于New England Journal of Medicine,引起了结直肠癌领域专家的广泛关注和讨论。2023年7月,Journal of Clinical Oncology(IF=45.3)发表了题为“Patient-Reported Outcomes During and After Treatment for Locally Advanced Rectal Cancer in the PROSPECT Trial (Alliance N1048)” 的文章3,公布了PROSPECT研究中保留括约肌手术前新辅助氟尿嘧啶和奥沙利铂(FOLFOX)组与新辅助氟脲嘧啶盆腔放化疗(5FUCRT)组的美国国家癌症研究所的不良事件通用术语标准患者报告结局版本(PRO-CTCAE)和健康相关生活质量(HRQL)结果。北美地区局晚期直肠癌的标准治疗方案是5FUCRT。
研究设计
PROSPECT 是一项多中心、非盲、随机对照的非劣效性III期研究。研究纳入未经治疗的局部晚期直肠癌患者,临床分期为T2N+、T3N-或者T3N+,经评估可行保留括约肌手术。患者以1:1的比例随机分配至FOLFOX组和5FUCRT组。主要终点为无病生存期(DFS)。次要终点包括总生存期(OS)、手术和病理结果以及患者报告结果(PRO),包括14种症状,这些症状来自PRO-CTCAE。其他PRO量表包括肠、膀胱、性功能和与HRQL。
研究结果
2012年6月至2018年12月,1128例患者按照分配的方案进行治疗,940例患者提供了PRO-CTCAE数据(FOLFOX组493例;5FUCRT组447例)。年龄中位数为57岁(范围19-86岁)(表1)。在新辅助治疗期间,FOLFOX组患者报告的腹泻率明显降低,总体肠道功能更好,而5FUCRT组焦虑、食欲减退、便秘、抑郁、吞咽困难、呼吸困难、水肿、疲劳、黏膜炎、恶心、神经病变和呕吐均较低(多重校正后P < 0.05)(图1)。术后12个月,与5FUCRT组相比,随机分配到FOLFOX组的患者报告的疲劳和神经病变发生率显著降低(多重校正后P < 0.05)(图1)。
表1 患者基线特征
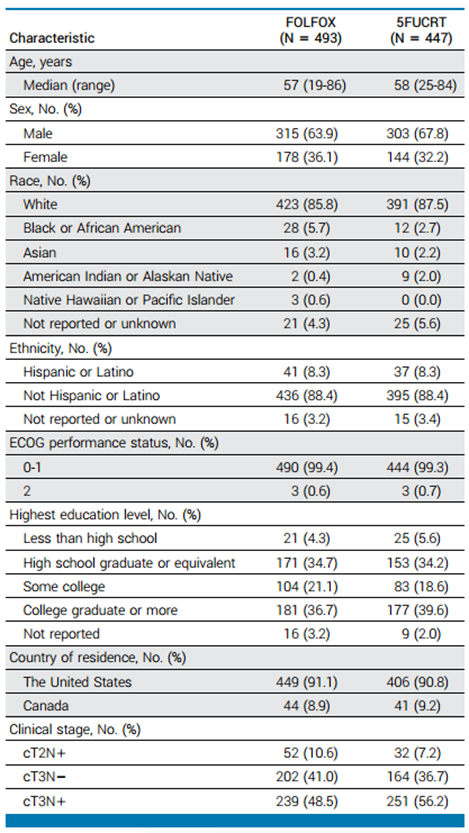

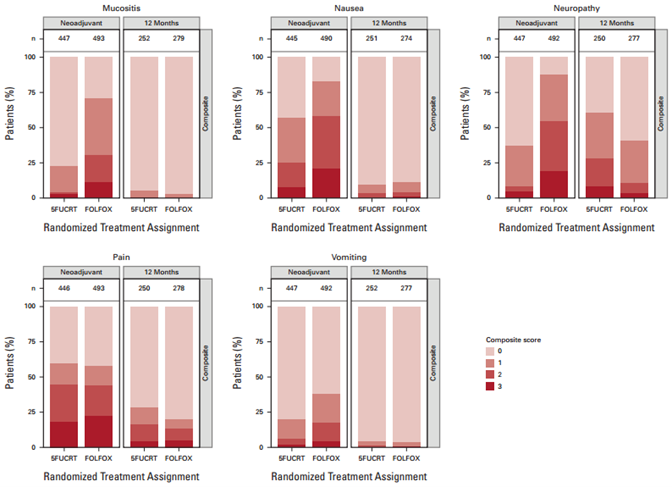
图1 在新辅助治疗期间和手术后12个月各症状的PRO-CTCAE综合评分分布
(颜色越深,症状越重)
从373名患者中得出的额外PROs表明,与5FUCRT组相比,FOLFOX组患者术前肠道功能显著更佳,术后12个月的男性及女性性功能更好(12个月时,原始P<0.01,多重校正后P<0.05)(图2 B-D)。调整多重比较后,在任何时间点均未检测到膀胱功能或总体HRQL的显著差异(图2 A、E)。

图2 在新辅助治疗期间和术后12个月、24个月组间基线的平均变化
研究结论
对于局部晚期直肠癌患者,在新辅助FOLFOX和5FUCRT之间进行选择时,两种方案独特的PRO特征可为治疗选择和共同决策提供信息。
专家锐评

结直肠癌是一个全球性重大健康问题,全世界每年有190万新增病例和近100万死亡病例。自1990年以来,5FUCRT一直是北美局部晚期直肠癌的标准治疗方法。然而5FUCRT有短期和长期毒性作用,尤其是肠道和性功能损害。当存在具有相似临床获益的治疗方案时,对不良事件(包括发生时间和严重程度)的了解,可能特别有助于个体治疗选择3,4。
PROSPECT研究既往结果显示新辅助FOLFOX在主要终点DFS上不劣于新辅助5FUCRT。该研究进一步探索了两种治疗方案的PROs情况,证明了PROs在描述患者感觉和功能方面的价值。该研究是PRO-CTCAE的一个里程碑,它是第一个嵌入PRO-CTCAE的大型试验。研究结果表明,与目标的新辅助标准治疗方案5FUCRT相比,接受新辅助FOLFOX方案的患者腹泻率明显降低,总体肠道功能更好,而5FUCRT组焦虑、食欲减退、便秘、抑郁、吞咽困难、呼吸困难、水肿、疲劳、黏膜炎、恶心、神经病变和呕吐的发生率较低。鉴于FOLFOX 和5FUCRT 在DFS方面的非劣效性和其他次要疗效终点的相似性,这些发现可为患者及临床医生的决策提供信息:对于担心术前治疗中出现急性肠道功能损伤,或术后一年或更长时间出现疲劳和性功能减退的患者,FOLFOX方案可能是更合适的选择。而除肠道功能以外的副作用,5FUCRT治疗的术前副作用更少,对一些患者可能仍是合适的。

研究背景
HER2过表达或扩增发生在约20%的胃/胃食管交界处(G/GEJ)腺癌患者中,并且在抗HER2治疗后可能导致表达水平降低。T-DXd作为一种抗体-药物偶联物,由抗HER2抗体、可裂解的四肽基连接体和膜渗透性拓扑异构酶I抑制剂有效负载组成,已被批准用于治疗既往接受过基于曲妥珠单抗方案治疗的局部晚期或转移性 HER2 阳性G/GEJ腺癌患者。但对于HER2 低表达G/GEJ腺癌患者尚缺乏有效靶向治疗方案。2023年2月,《Journal of Clinical Oncology》杂志发表的DESTINY-Gastric01的探索性队列分析结果,旨在探讨 T-DXd在HER2低表达G/GEJ腺癌患者中的疗效和安全性6。
研究方法
DESTINY-Gastric01是一项来自韩国和日本的多中心、开放、Ⅱ期临床研究,纳入局部晚期或转移性HER2低表达的G/GEJ腺癌患者,21例患者纳入队列1 (HER2 免疫组化[IHC]2+/原位杂交阴性[ISH-]),24例患者纳入队列2(IHC 1+);队列1有20例(95.2%),队列2 有24例患者(100%)接受T-DXd治疗。纳入患者既往至少接受两种治疗方案(包括氟嘧啶和铂类),但未接受过抗HER2治疗,接受T-DXd 6.4 mg/kg,Q3W IV。主要终点为独立中央审查(ICR)评估的客观反应率(ORR)。
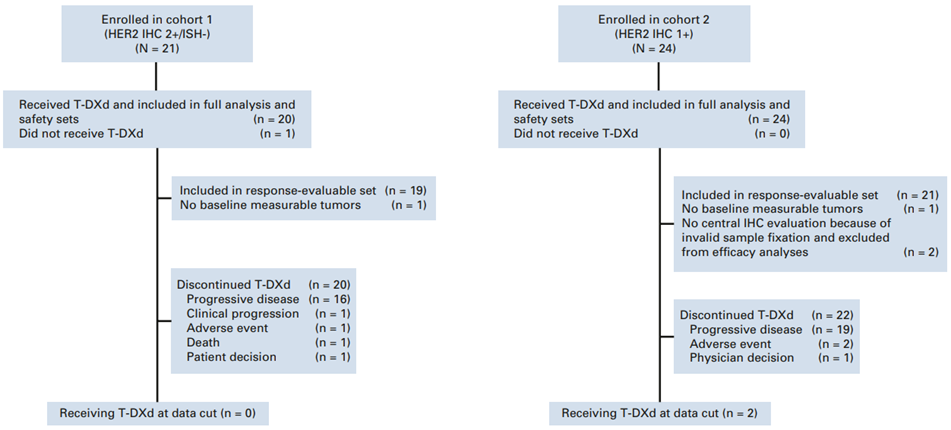
图1 患者匹配图
研究结果
疗效数据
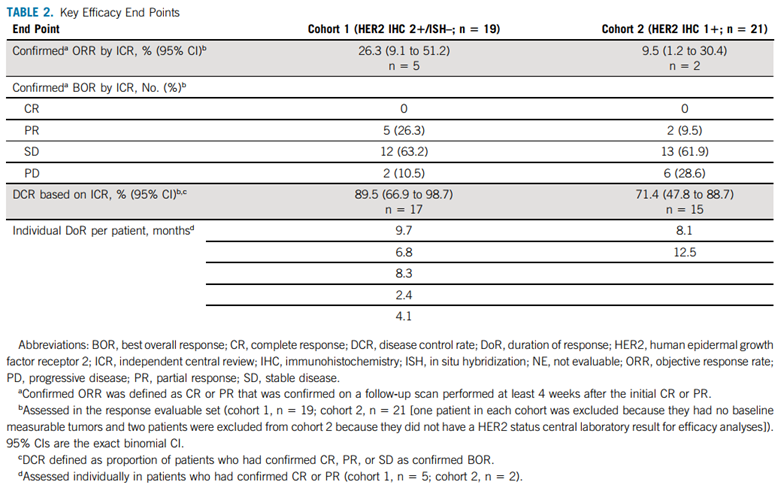
队列1的19例可评估反应患者中, 确认的ORR率达26.3%(95%CI,9.1-51.2%),队列2的21例可评估反应患者中,确认的ORR为9.5%(95%CI,1.2-30.4%)。两组患者均为部分缓解(PR),均未出现完全缓解(CR)。队列1和队列2疾病控制率(DCR)分别为89.5%和71.4%,确认ORR患者的中位缓解持续时间(DOR)分别为7.6个月和12.5个月。
表1 ORR 、DCR、DOR数据
队列1、队列2分别有 68.4%(13例)和60%(12例)患者出现肿瘤体积缩小。
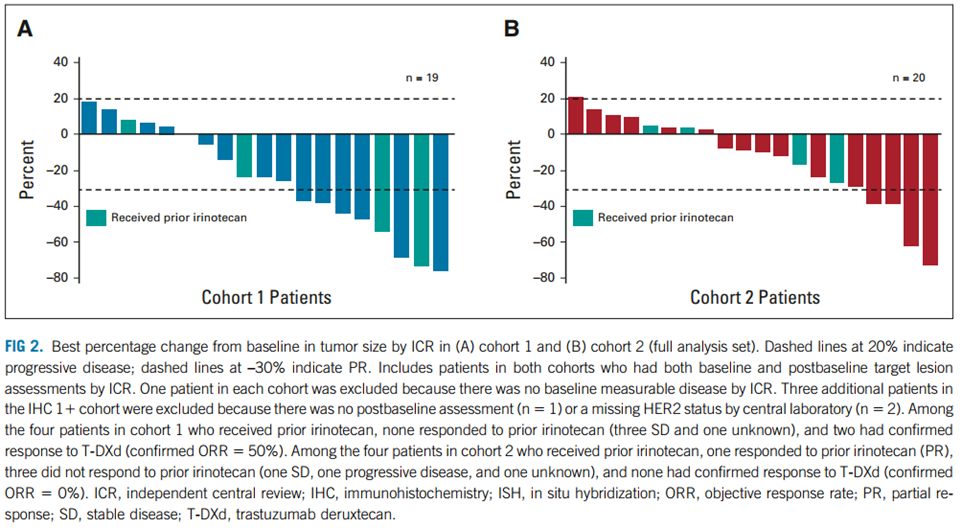
图2 队列1(A)和队列(B)与基线相比肿瘤大小变化最佳百分比
队列1的中位总生存期(mOS)为7.8个月(95% CI,4.7-NE),队列2的mOS为8.5个月(95%CI,4.3-10.9);队列1和队列2经ICR评估的中位无进展生存期(mPFS)分别为4.4个月(95% CI,2.7-7.1)和2.8个月(95% CI,1.5-4.3)。
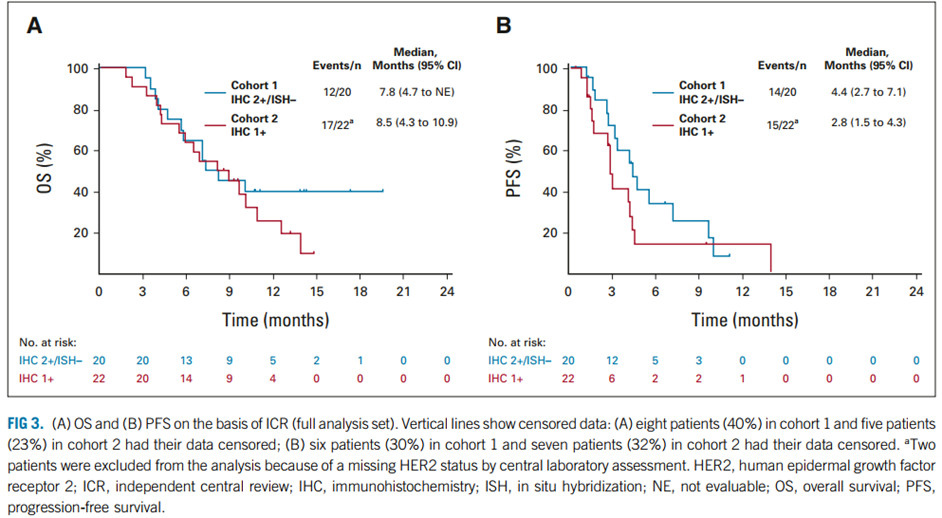
图3 队列1和队列2患者OS(A)和PFS(B)数据
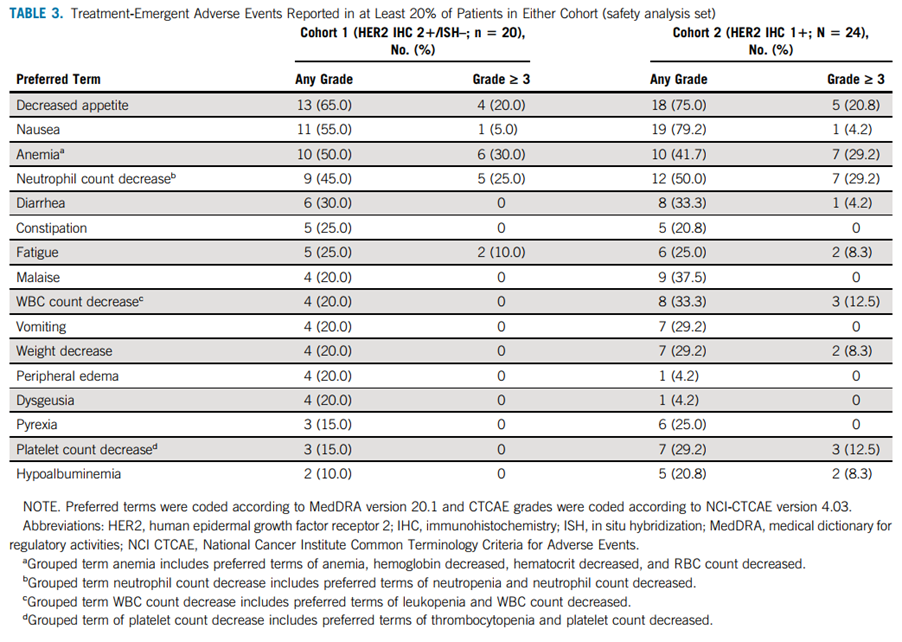
所有患者都至少经历了一次治疗紧急不良事件(TEAE),队列1和队列2 ≥3级TEAE发生率分别为70%和79.2%。在队列1和队列2中,最常见的≥3级TEAE包括贫血、中性粒细胞计数下降和食欲下降。在每个队列中,各有1例的患者发生了与药物相关的间质性肺疾病(ILD)/肺炎。没有发生导致死亡的TEAE。
研究结论
本研究初步证明T-DXd在HER2低表达G/GEJ腺癌患者中具有临床活性。未来仍需要进一步的研究数据支持这一结论。
专家锐评

临床前研究表明,T-DXd对包括G/GEJ腺癌在内的HER2低表达肿瘤具有抗肿瘤作用。既往一项III期临床试验也显示,T-DXd在HER2低表达的乳腺癌患者中相较于化疗,可显著延长PFS和OS。T-DXd在HER2低表达G/GEJ腺癌中的活性可能归因于起具有高膜通透性的特点,使得它能够渗透到HER2不表达或低表达的临近细胞中,发挥旁观者效应。此外,T-DXd具有高药物抗体以及在HER2低表达肿瘤中的临床活性,进一步支持其用于HER2低表达肿瘤细胞。
目前临床尚缺乏针对HER2低表达G/GEJ腺癌的有效治疗方法。在G/GEJ腺癌患者中,HER2表达具有异质性,且HER2阳性表达水平经常在曲妥珠单抗治疗后消失或降低。曲妥珠单抗作为一线推荐用于HER2 阳性(IHC3+或IHC 2+和ISH+)G/GEJ腺癌患者已有数十年,当HER2表达水平降低后继续使用曲妥珠单抗已经失效。其他三线用于G/GEJ腺癌的药物包括三氟吡啶/替吡拉西,但在HER2低表达患者中ORR仅为4%,远低于本研究中T-DXd治疗队列1和队列2的26.3%和9.5%,这提示T-DXd可抑制HER2低表达G/GEJ腺癌的肿瘤生长。然而,队列2(IHC1+)的ORR未达到预设标准,需要进一步研究调查。
本研究也存在局现性,入组患者数较少,患者多来自日本和韩国,且为非对照性研究。未来需要在更广大的人群中验证T-DXd对HER2低表达G/GEJ腺癌的治疗效果。
参考文献:
1. Chen B, Zhao H, Huang J, et al. Efficacy of regorafenib combined with PD-1 inhibitors in elderly patients with advanced metastatic colorectal cancer. BMC Geriatr. 2022 Dec 21;22(1):987.
2. Lu H, Zheng C, Fan L, Xiong B. Efficacy and Safety of TACE Combined with Regorafenib versus TACE in the Third-Line Treatment of Colorectal Liver Metastases. J Oncol. 2022 Dec 3;2022:5366011.
3. 中国医师协会外科医师分会,中华医学会外科分会胃肠外科学组,中华医学会外科分会结直肠外科学组, 等. 中国结直肠癌肝转移诊断和综合治疗指南(2023版)[J]. 中国普通外科杂志, 2023, 32(1):1-29.
4. Basch E, Dueck AC, Mitchell SA, Mamon H, Weiser M, Saltz L, Gollub M, Rogak L, Ginos B, Mazza GL, Colgrove B, Chang G, Minasian L, Denicoff A, Thanarajasingam G, Musher B, George T, Venook A, Farma J, O'Reilly E, Meyerhardt JA, Shi Q, Schrag D. Patient-Reported Outcomes During and After Treatment for Locally Advanced Rectal Cancer in the PROSPECT Trial (Alliance N1048). J Clin Oncol. 2023 Jul 20;41(21):3724-3734.
5. Dohrn N, Klein MF. Colorectal cancer: current management and future perspectives. Br J Surg. 2023 Sep 6;110(10):1256-1259.
6. Yamaguchi K,et al. Trastuzumab Deruxtecan in Anti-Human Epidermal Growth Factor Receptor 2 Treatment-Naive Patients With Human Epidermal Growth Factor Receptor 2-Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial. J Clin Oncol. 2023;41(4):816-825.
