GI医声 第7期 I 靶向、免疫治疗引领消化道肿瘤新风向,全面布局一线和后线
医脉通 2023.12.15

GI 医声
13条内容

导读:靶向治疗和免疫治疗的出现,改变了多个肿瘤的治疗格局。近年来,靶免治疗在消化道肿瘤领域的突破和进展不断给我们带来惊喜,全面布局晚期消化道肿瘤的一线和后线治疗,为患者带来更多治疗新选择。本期GI医声特邀河北医科大学第四医院史健教授、云南省肿瘤医院刘萍教授、江苏省肿瘤医院孙小峰教授、江南大学附属医院高翔教授分享消化道肿瘤领域靶向、免疫治疗前沿进展,期待为消化道肿瘤的治疗提供新思路。

2023 ASCO会议上,一项瑞戈非尼联合TAS-102治疗难治性转移性结直肠癌(mCRC)的一项多中心单臂II期研究(REGTAS)荣登国际舞台,为mCRC患者的治疗提供了新方向1。
研究背景
瑞戈非尼和/或TAS-102是晚期转移性结直肠癌(mCRC)标准治疗药物。单药治疗效果欠佳,难以满足更高的临床需求。
瑞戈非尼作为可以抑制肿瘤血管生成和肿瘤细胞增殖的靶向药物,具有独特的作用机制及其与其他药物副作用不重叠的特性,成为一种理想的联合治疗药物。设想瑞戈非尼与化疗药物联合应用,对肿瘤细胞进行双打击,提高抗肿瘤治疗效果。
I期研究REMETY研究显示,瑞戈非尼联合TAS-102 的4周标准治疗方案可行且安全,但考虑该研究中TAS-102治疗剂量仅25 mg/m2bid。为此,开展了REGTAS研究,旨在评估瑞戈非尼联合TAS-102治疗mCRC的疗效、安全性和最佳剂量搭配。1
研究设计
REGTAS是一项多中心II期临床试验,5个中心纳入既往治疗失败的mCRC患者16例,11例(68.7%)的患者在确诊后18个月内入组,8例(50%)患者检测到RAS突变。其中13例接受过至少一次评估。在体能状况允许的情况下,采用瑞戈非尼联合TAS-102治疗难治性mCRC。瑞戈非尼120mg/d(或起始剂量80mg/d,随后每周40mg剂量递增至120mg/d),每21天为一个周期;TAS-102 30 mg/m2,每日两次,第1~5天,每两周为一个周期。主要终点为无进展生存期(PFS)。次要终点包括安全性、疾病控制率(DCR)和总生存期(OS)。
研究结果
疗效数据
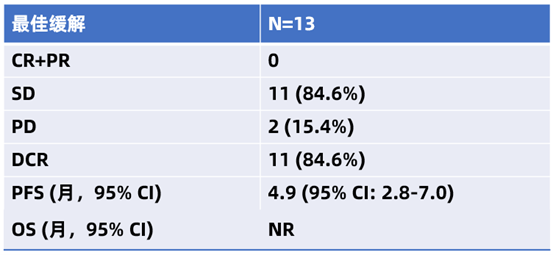
截至2022年12月31日,在疗效可评估的13 例患者中,11例患者达到疾病稳定(SD),2例患者出现疾病进展(PD)。患者中位 PFS 为4.9个月 (95% CI:2.8-7.0),中位OS未达到。整体患者的疾病控制率(DCR)达到 84.6%(95% CI:54.6%-98.1%)(表1)。
表1 REGTAS研究疗效数据
安全性数据
所有患者都出现了不同级别的治疗相关不良事件(TRAE),常见的不良反应包括手足综合征(62.5%)、高血压(68.8%)、疲劳(50%),中性粒细胞减少(43.8%)等。其中4例(25%)患者发生≥3级不良反应,2例(9.5%)患者需要减少瑞戈非尼剂量。患者整体安全性尚可,可耐受。
研究结论
瑞戈非尼与TAS-102二者联合治疗不良反应可控可耐受,可能为晚期mCRC患者的治疗提供新的治疗选择。未来仍需要进一步的研究来验证这一方案。
专家锐评

2023 ASCO 公布的REGTAS研究,证明了瑞戈非尼联合化疗在mCRC后线治疗中具有一定的受益,安全性可耐受1。此前,2022 ASCO入选一项瑞戈非尼联合卡培他滨治疗中国mCRC患者的真实世界研究,患者中位PFS达到8个月,中位OS达到26.9个月2。这两个临床试验提示瑞戈非尼联合化疗治疗mCRC的前景。
两个临床试验中瑞戈非尼和TAS-102的剂量设置均与临床实践相契合,瑞戈非尼的起始剂量为120mg/d或者从80mg/d逐步增量至120mg/d,结果显示瑞戈非尼120mg/d联合TAS-102 30 mg/m2 bid临床疗效优于单药治疗,不良反应发生率低,能够有效平衡患者的治疗效果和生活质量。
2023 ASCO发表的一项瑞戈非尼联合塞来昔布的研究3,瑞戈非尼预防性联合塞来昔布后,瑞戈非尼起始剂量≥120mg的患者比例高达77%,3级以上手足综合征(HFS)的发生率为0,并未缩短患者的生存期3。提示瑞戈非尼联合化疗时,可预防性使用塞来昔布,降低瑞戈非尼严重级别手足综合征的发生且改善耐受性。未来还需要更多大型前瞻性研究来进一步探索瑞戈非尼联合化疗方案的最佳组合剂量,从而帮助患者实现更长的生存和更好的生活质量。

研究背景
对于RAS野生型转移性结直肠癌(mCRC)患者,在一线双药化疗中加入抗表皮生长因子受体(抗EGFR)或抗血管内皮生长因子(抗VEGF)单克隆抗体都是常规治疗,但孰优孰劣尚未明确。2023年4月,全球知名学术期刊JAMA上发表了在RAS野生型mCRC患者中,对比帕尼单抗与贝伐珠单抗联合标准一线化疗的随机对照研究结果4,并受到学界广泛关注。
研究设计
2015年5月至2022年1月,该随机、开放标签3期临床试验纳入了日本197个中心823例未经治疗的RAS野生型不可切除mCRC患者。按照1:1随机分配接受帕尼单抗(n=411)或贝伐珠单抗(n=412)联合mFOLFOX6一线治疗。主要终点为左侧CRC和总体人群的总生存期(OS),次要终点包括无进展生存期(PFS)、缓解率、缓解持续时间(DoR)、R0切除率。
研究结果
研究入组802例患者,中位年龄为66 岁,604例(75.3%)为左侧CRC。中位随访时间为61个月。在左侧CRC患者中,帕尼单抗组的中位OS为37.9个月,贝伐珠单抗组为34.3个月,死亡风险比(HR)为0.82(95% CI:0.68-0.99,P=0.03;总体人群中,二者中位OS分别为36.2个月和31.3个月,HR为0.84(95% CI:0.72-0.98,P=0.03)。
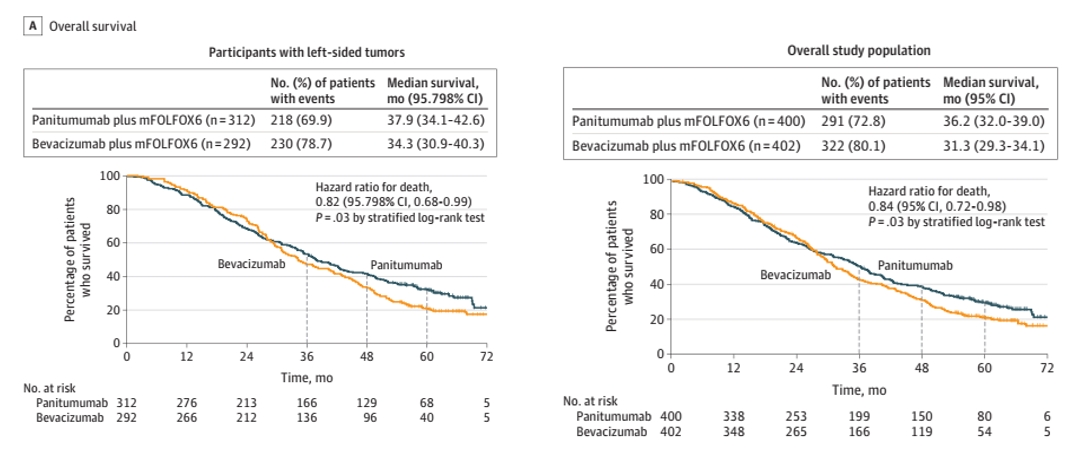
图1 左侧CRC与总体人群的OS
对于左侧CRC患者,帕尼单抗与贝伐珠单抗的中位PFS分别为13.1个月和 11.9个月(HR,1.00;95% CI,0.83-1.20);总体人群中,两者PFS分别为12.2个月和11.4个月(HR,1.05;95%CI:0.90-1.24)。
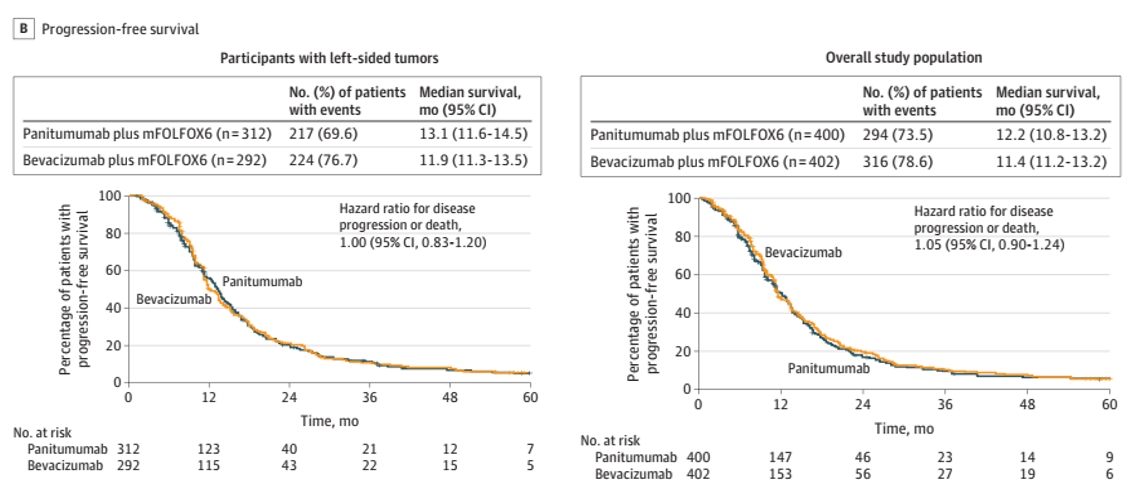
图2 左侧CRC与总体人群的PFS
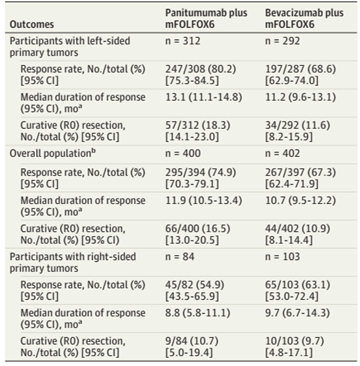
帕尼单抗与贝伐珠单抗的缓解率在左侧CRC患者中,分别为80.2%和68.6%;总体人群中,缓解率分别为74.9%与67.3%。
对于左侧CRC,帕尼单抗与贝伐珠单抗的中位DoR分别为 13.1 个月和 11.2个月;总体人群中,中位DoR分别为11.9个月与10.7个月。
对于左侧CRC,帕尼单抗与贝伐珠单抗的R0切除率分别为18.3%和11.6%;总体人群中,该比例分别为 16.5%和10.9%。
表1 左侧CRC与总体人群的缓解率、DoR、R0切除率
安全性方面,常见的治疗期间出现的不良事件为痤疮样皮疹(帕尼单抗为74.8%,贝伐珠单抗为3.2%)、周围感觉神经病变(帕尼单抗为70.8%,贝伐珠单抗为73.7%)和口腔炎(帕尼单抗为61.6%,贝伐珠单抗为40.5%)。
研究结论
在标准一线化疗基础上联合帕尼单抗相较联合贝伐珠单抗改善了左侧和总体RAS野生型mCRC患者的OS。
专家锐评

对于不可切除转移性或复发性CRC患者,全身化疗是标准治疗方案。在此基础上,联合使用抗EGFR或抗VEGF单克隆抗体可将患者的中位OS进一步延长4。近年来,随着靶向治疗研究的深入,越来越多靶向药物(如帕尼单抗、贝伐珠单抗等)在国内外相继获批5。临床指南推荐左侧RAS野生型CRC患者一线使用化疗联合抗EGFR抗体或抗VEGF抗体贝伐珠单抗4。
本研究探讨了RAS野生型mCRC患者分别接受帕尼单抗与贝伐珠单抗联合标准一线化疗的治疗结局。结果发现,在原发瘤位于左侧的RAS野生型CRC患者中,抗EGFR抗体联合化疗一线治疗的获益更高。在左侧CRC患者中,帕尼单抗组的中位OS为37.9个月,贝伐珠单抗组为34.3个月;总体人群中,二者中位OS分别为36.2个月和31.3个月。值得注意的是,虽然本研究结果显示帕尼单抗组总体人群的OS也有显著改善,但亚组分析发现,在右侧CRC患者中,帕尼单抗+mFOLFOX6和贝伐珠单抗+mFOLFOX6两种方案的OS无显著差异,这提示生存获益主要发生在左侧CRC患者中。另外,研究者还发现,在前28个月内,两组的生存曲线无明显差异,即使在左侧CRC患者中也是如此。因此有必要进一步探索可能解释这些差异的其他生物标志物,如BRAF、ERBB2(HER2)和微卫星不稳定(MSI)4。

研究背景
大约15%的成年胃肠间质瘤(GIST)患者携带KIT/PDGFRα(血小板源性生长因子受体α)野生型(KP-wtGIST)肿瘤。这些肿瘤通常具有琥珀酸脱氢酶(SDH)缺陷,表现出更惰性的行为,并且对伊马替尼具有耐药性。2023年8月,Molecular Cancer(IF=37.3)发表了 REGISTRI研究结果6,该研究旨在探索瑞戈非尼在晚期KP-wtGIST一线治疗中的应用。
研究设计
一项II期临床试验,在经过二代测序中心确认的情况下,纳入了来自西班牙、法国和意大利的15个中心的未接受过晚期疾病全身治疗的晚期KP-wtGIST成年患者。符合条件的患者接受瑞戈非尼治疗,每天160 mg,每28天治疗21天。主要终点是疾病控制率(DCR)。
研究结果
从2016年5月到2020年10月,16例晚期GIST患者经由NGS中心分子筛选确认为KP-wtGIST。最终有15例患者被纳入研究并接受瑞戈非尼治疗。由于COVID疫情的爆发导致招募速度缓慢,研究提前结束,最终数据分析的临床截止日期为2021年11月9日。患者中位年龄为57岁。肿瘤部位:胃10例(67%),肠2例(13%),肠系膜3例(20%)(表1)。
表1 患者基线特征

中心评估显示,12周时的DCR为86.7%(图1)。9例(60%)患者肿瘤缩小(图2)。根据RECIST标准和中心放射学评估,2例(13%)的患者出现部分缓解(PR),13(87%)的患者疾病稳定(SD)。与其他KP-wtGIST患者相比,SDH缺陷型GIST患者表现出更好的临床疗效(图3)。
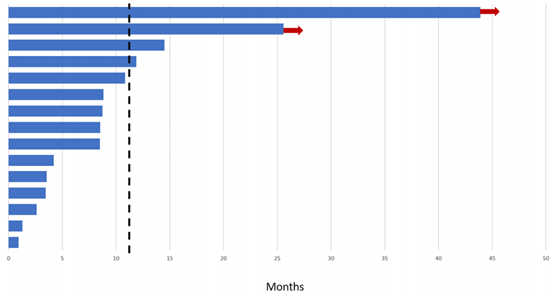
图1 PFS游泳图
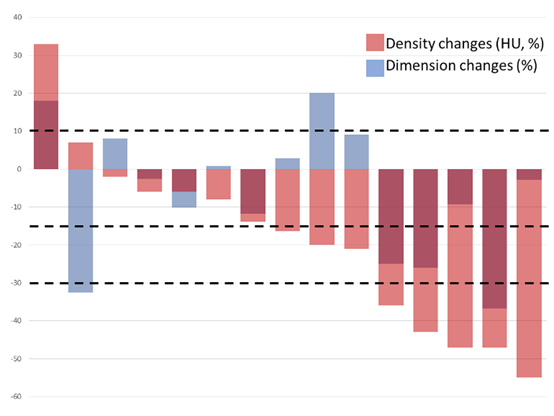
图2 肿瘤反应瀑布图(RECIST和Choi)
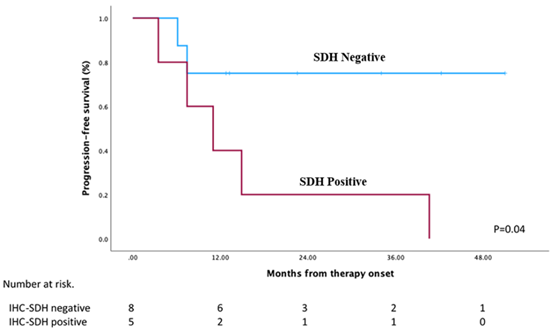
图3 SDH IHC染色阳性和阴性的PFS情况
研究结论
与其他酪氨酸激酶抑制剂相比,瑞戈非尼在KP-wtGIST中的活性良好,尤其是在SDH缺陷的GIST亚群中,应将其作为晚期KP-wtGIST的前期治疗。
专家锐评

约10-15%的成人GIST患者和85%的儿童GIST患者不携带KIT或PDGFRα突变,被称为KP-wtGIST。KP-wtGIST患者中SDH缺陷型GIST占比高。SDH缺陷导致细胞内琥珀酸堆积,后者作为促癌代谢物可引发多种表观遗传学和代谢改变,促进肿瘤发生发展。该型GIST以手术治疗为主,对伊马替尼治疗反应不佳6,7。
瑞戈非尼是一种口服多激酶抑制剂,靶向血管生成(VEGFR1-3、TIE2)、基质(PDGFR-b、FGFR)和致癌激酶(KIT、RET、RAF-1、BRAF和BRAFV600E)。此外,早期Cajal间质细胞(ICC)祖细胞的表型为KITlowCD44+CD34+IGFR+,而成熟系祖细胞的表型为KIThighCD44+CD34-IGFR-。与成熟的或更稳定的线型 ICC 不同,尽管 Kit 信号通路激活,但 KITlowCD44+CD34+IGFR+表现出对伊马替尼的耐药性。有趣的是,至少50%的KP-wGIST过表达IGFR1。这种过表达可能与IGF自分泌环路导致的SDH缺乏有关。IGFR通过MAPK以及其他信号通路发出信号,这些信号可能被瑞戈非尼不同程度地抑制。对于晚期 KP-wGIST患者的前期治疗,瑞戈非尼可能比伊马替尼更具优势6。既往亦有研究显示瑞戈非尼可能使部分SDH缺陷型GIST患者获益8。这项研究显示,瑞戈非尼能够让大部分患者(86.7%)获得较长时间的不进展。根据RECIST和Choi标准,分别有13%和54%的患者实现PR,这些结果提示临床可将瑞戈非尼作为晚期KP-wtGIST的前期治疗6。
该研究也有一些局限性,经NGS测序后,47%经Sanger测序的假定KP-wGIST其实是KIT或PDGFRα突变GIST,这阻碍了招募的预期,导致研究提前结束。另一个局限性是生活质量调查问卷的依从性较低,这可能与研究的学术性质有关,因为预算紧张限制了现场监测6。
研究背景
斯鲁利单抗(HLX10)是一种完全人源化的、选择性的抗PD-1受体免疫球蛋白G4单克隆抗体。在II期研究中,斯鲁利单抗在多种肿瘤类型中展现出良好的抗肿瘤活性和可控的安全性。综合这些研究的发现以及对给药间隔时长和PD-L1联合阳性评分(CPS)的分析,研究者开展了ASTRUM-007研究,旨在评估斯鲁利单抗+化疗(5-FU+顺铂)与安慰剂+化疗作为PD-L1 CPS≥1的局部晚期或转移性ESCC患者一线治疗的疗效和安全性,给药频率为每两周一次。2023年2月2日,Nature Medicine在线发表了ASTRUM-007研究结果9。
研究设计
研究共入组551例既往未接受过治疗、PD-L1 CPS≥1的晚期ESCC患者,以2∶1的比例随机分配至斯鲁利单抗+化疗组(n=368)和安慰剂+化疗组(n=183)。斯鲁利单抗+化疗组有162名患者PD-L1 CPS≥10,安慰剂+化疗组的有79名患者PD-L1 CPS≥10。
研究的主要终点是独立放射学审查委员会(IRRC)评估的无进展生存期(PFS)和总生存期(OS),次要终点包括研究者(INV)评估的PFS、IRRC评估的客观缓解率(ORR)和缓解持续时间(DOR)。
研究结果
PFS数据
截至2022年4月15日,斯鲁利单抗+化疗组经IRRC评估的中位PFS明显长于安慰剂+化疗组(5.8 vs. 5.3个月;HR=0.60,P<0.0001),INV评估的结果相似(HR=0.56)。IRRC评估的斯鲁利单抗+化疗组12个月PFS率是安慰剂+化疗组的2.8倍(26% vs. 9%)。
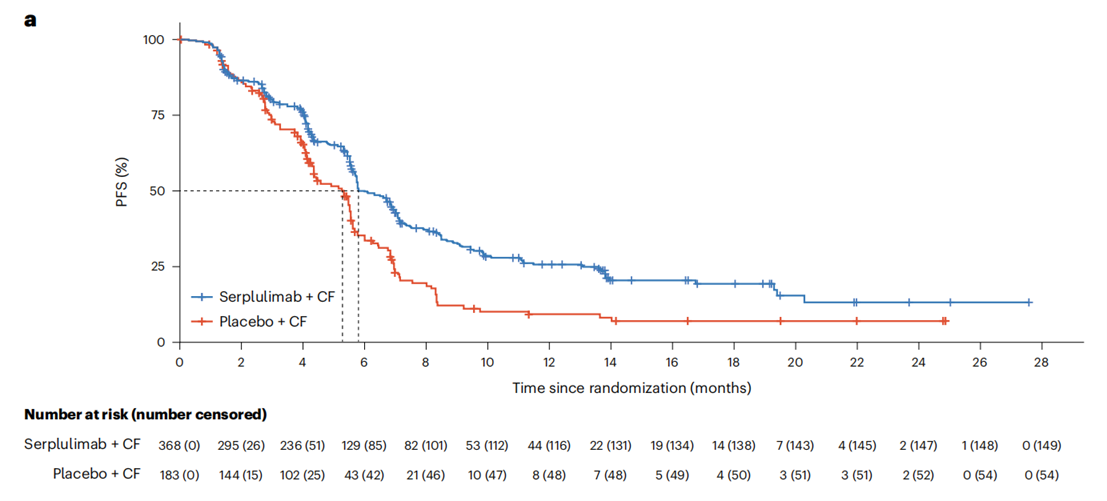
图1 ASTRUM-007研究IRRC评估的PFS结果
OS数据
在数据截止日期,斯鲁利单抗+化疗组的中位OS显著优于安慰剂+化疗组(15.3个月 vs. 11.8个月;HR=0.68,95%CI:0.53-0.87,P=0.0020)。
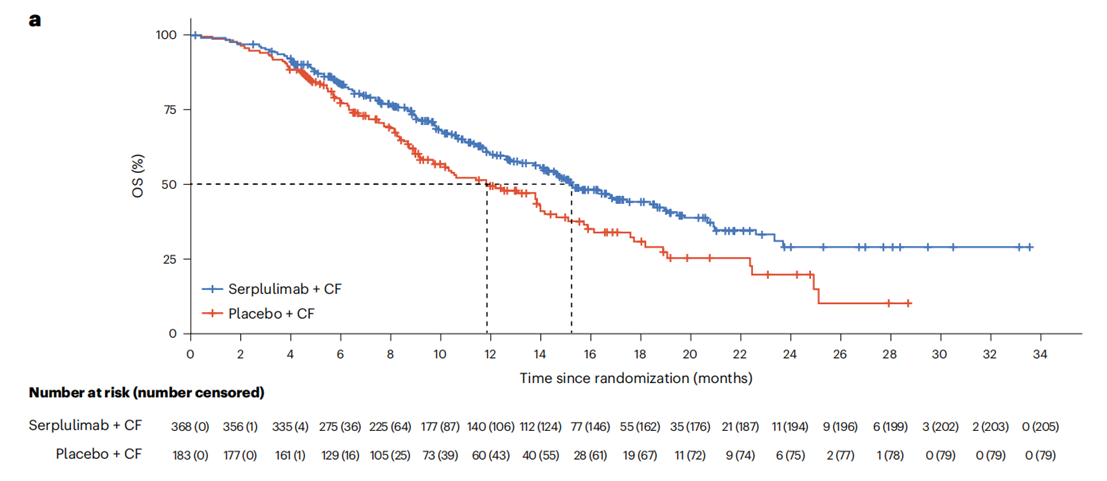
图2 ASTRUM-007研究的OS结果
ORR、DOR数据
根据IRRC评估,斯鲁利单抗+化疗组的ORR为57.6%,安慰剂+化疗组为42.1%(OR=1.85;P=0.0007)。两组的中位DOR分别为6.9个月和4.6个月,两组的6个月、12个月、18个月DOR率分别为53%和32%、36%和15%、20%和12%。研究者评估的抗肿瘤活性与IRRC评估的相似。
安全性数据
在斯鲁利单抗+化疗组和安慰剂+化疗组中观察到任何级别的治疗相关不良事件(TRAE)发生率均为98%,两组的3级及以上TRAE发生率分别为53%和48%。最常报告的3级及以上TRAE为贫血、中性粒细胞计数减少和白细胞计数减少。
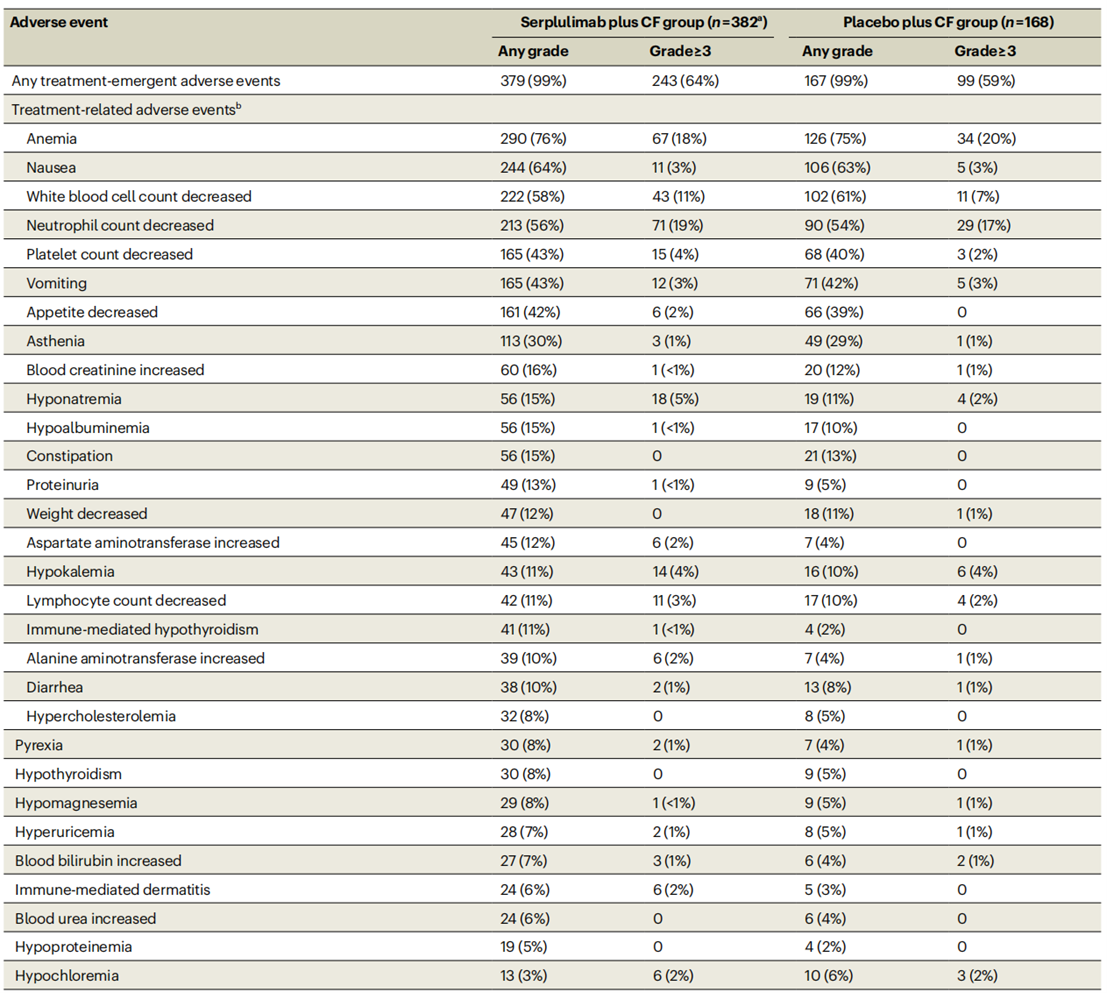
图3 安全性数据
研究结论
ASTRUM-007研究结果显示,与单纯化疗相比,每两周予以斯鲁利单抗联合化疗可显著改善既往未接受过治疗的PD-L1阳性、晚期ESCC患者的PFS和OS,且安全性可控,该治疗方案为这部分患者带来了新的治疗选择。
专家锐评

近年来,免疫检查点抑制剂改变了晚期ESCC的系统治疗格局。在几项晚期ESCC一线治疗的III期临床研究中,PD-1抑制剂联合化疗对比单纯化疗可显著改善晚期ESCC患者的OS获益。与之相一致的是,ASTRUM-007研究中,对于PD-L1 CPS≥1的晚期ESCC患者,斯鲁利单抗联合化疗相对单纯化疗降低了患者死亡风险32%,而且斯鲁利单抗联合化疗组的12个月和24个月生存率较单纯化疗组分别高出约11%和9%,这表明斯鲁利单抗具有长期疗效。除此之外,ASTRUM-007研究还提示,加入斯鲁利单抗后,患者的ORR也表现出具有临床意义的改善(57.6% vs. 42.1%;P=0.0007)。安全性方面,每两周给药一次,患者耐受性良好,两个治疗组的各类不良事件发生率相似,且该研究中观察到的TRAE与两类药物各自的TRAE一致,未发现新的安全性信号。综上所述,PD-1抑制剂联合化疗是晚期ESCC的标准一线治疗方案。
与探索有效治疗方案同样重要的是,明确预测免疫检查点抑制剂治疗疗效的生物标志物,也有助于改善患者生存获益。上述几项III期研究的亚组进行了相关分析,结果表明,与PD-L1低表达或阴性的ESCC患者相比,PD-L1表达较高的患者加用PD-1抑制剂治疗可能获得更优的疗效。PD-L1的高表达已被认为是可预测PD-1抑制剂治疗晚期ESCC患者疗效的潜在生物标志物。
这些研究中使用了两种主要的评分算法,即肿瘤比例评分(TPS)和CPS,TPS仅使用表达PD-L1的肿瘤细胞计算,CPS则捕捉PD-L1表达阳性的淋巴细胞和巨噬细胞。而CPS比TPS更有可能识别出更多能从PD-1抑制剂治疗中获益的患者,因此ASTRUM-007研究使用CPS算法来筛选患者,但这种假设的优效性尚未得到证实。另外,部分研究表明PD-L1 CPS≥10的患者OS获益优于1≤PD-L1 CPS<10的患者,但另有部分研究则显示并无明显差异。这些结果提示,CPS在低评分患者中的预测作用尚待明确,仍需进一步研究以明确能有效预测治疗疗效的PD-L1表达阈值。
参考文献:
1.Wang XL,et al. Efficacy and safety of regorafenib plus biweekly TAS-102 for refractory metastatic colorectal cancer (REGTAS): A multicenter single-arm phase II trial. J Clin Oncol 41, 2023 (suppl 16; abstr e15567).
2.Li XF,et al. A multiple centers real-world study of regorafenib treatment modalities in Chinese metastatic colorectal cancer patients. 2022 ASCO abstract e15543.
3.Wang L, et al. The preventive effect of celecoxib on regorafenib-associated hand-foot syndrome in patients with liver metastasis from colorectal cancer: A single-center, retrospective, real-world study. J Clin Oncol 41, 2023 (suppl 16; abstr e15576).
4.Watanabe J, Muro K, Shitara K, et al. Panitumumab vs Bevacizumab Added to Standard First-line Chemotherapy and Overall Survival Among Patients With RAS Wild-type, Left-Sided Metastatic Colorectal Cancer: A Randomized Clinical Trial. JAMA. 2023 Apr 18;329(15):1271-1282.
5.中国医师协会结直肠肿瘤专业委员会, 中国抗癌协会大肠癌专业委员会, 国家癌症中心国家肿瘤质控中心结直肠癌质控专家委员会. 结直肠癌靶向治疗中国专家共识. 中华普通外科学文献(电子版), 2023, 17(1): 1-8.
6.Martin-Broto J,et al. REGISTRI: Regorafenib in first-line of KIT/PDGFRA wild type metastatic GIST: a collaborative Spanish (GEIS), Italian (ISG) and French Sarcoma Group (FSG) phase II trial. Mol Cancer. 2023 Aug 9;22(1):127.
7.杨舒雅, 叶颖江, 高志冬. 琥珀酸脱氢酶缺陷型胃肠间质瘤研究进展[J]. 中国实用外科杂志, 2022, 42(03): 344-348.
8.童昕, 蒋祈, 张鹏, 等. 野生型胃肠间质瘤的特征与靶向治疗 [J] . 中华胃肠外科杂志,2020,23 (09): 907-910.
9.Song Y, Zhang B, Xin D, et al. ASTRUM-007 investigators. First-line serplulimab or placebo plus chemotherapy in PD-L1-positive esophageal squamous cell carcinoma: a randomized, double-blind phase 3 trial. Nat Med. 2023 Feb;29(2):473-482.
