GI医声 第8期 I 临床研究再添新证,消化道肿瘤领域前沿进展为患者带来突破和希望
医脉通 2023.12.16

GI 医声
13条内容

导读:结直肠癌和胃食管癌作为全球最普遍的胃肠道恶性肿瘤之一,一直是领域研究热点。近期,在2023 ESMO大会上,公布了一系列结直肠癌诊疗的最新研究进展,此外,《柳叶刀·肿瘤学》杂志上刊登了一项关于治疗胃或胃食管结合处(G/GEJ)腺癌的临床研究。这些研究可能为消化道肿瘤领域患者提供更多治疗选择和更长的生存机会。借此契机,本期GI医声特邀新疆肿瘤医院唐勇教授、山东第一医科大学第二附属医院刘海燕教授、浙江大学医学院附属第一医院赵鹏教授、湖南省肿瘤医院刘振洋教授分享消化道肿瘤领域的前沿研究,揭示这些研究可能为消化道肿瘤患者带来的希望和突破。

研究背景
近年来,结直肠癌领域免疫治疗的探索如火如荼。其中,3期KEYNOTE-177研究显示,与化疗±靶向治疗相比,MSI-H/dMMR转移性结直肠癌(mCRC)患者使用帕博利珠单抗一线治疗可改善无进展生存期(PFS),并具有总生存(OS)改善趋势。2023年ESMO大会上,KEYNOTE-177研究再次闪耀国际,报道了5年随访疗效和安全性结果1。
研究方法
研究纳入≥18岁、初治MSI-H/dMMR mCRC、具有RECIST v1.1可测量病灶、ECOG PS评分0或1的患者,按照1:1随机接受帕博利珠单抗或化疗(mFOLFOX6或FOLFIRI±贝伐珠单抗或西妥昔单抗)。接受化疗的患者在确认疾病进展(PD)后可接受≤35周期帕博利珠单抗治疗。5年终点是OS、PFS、反应持续时间(DOR)和安全性。
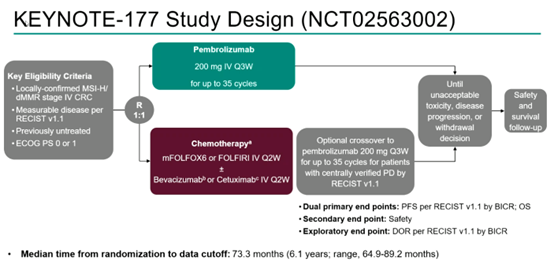
图1 研究设计
研究结果
数据截至2023年7月17日,中位随访73.3个月。帕博利珠单抗组的153例患者均接受了治疗,其中59例(38.6%)完成了35周期治疗;分配至化疗组的154例患者中有143例接受了治疗。帕博利珠单抗组和化疗组分别有94例(61.4%)和143例(100%)患者终止治疗,大多是由于PD(32.7%和60.8%)。化疗组57例(37.0%)患者达到交叉标准,接受了帕博利珠单抗治疗,21例(36.8%)完成了35周期帕博利珠单抗治疗。另外39例(25.3%)接受化疗的患者接受方案外的其他PD-1/PD-L1抑制剂治疗。
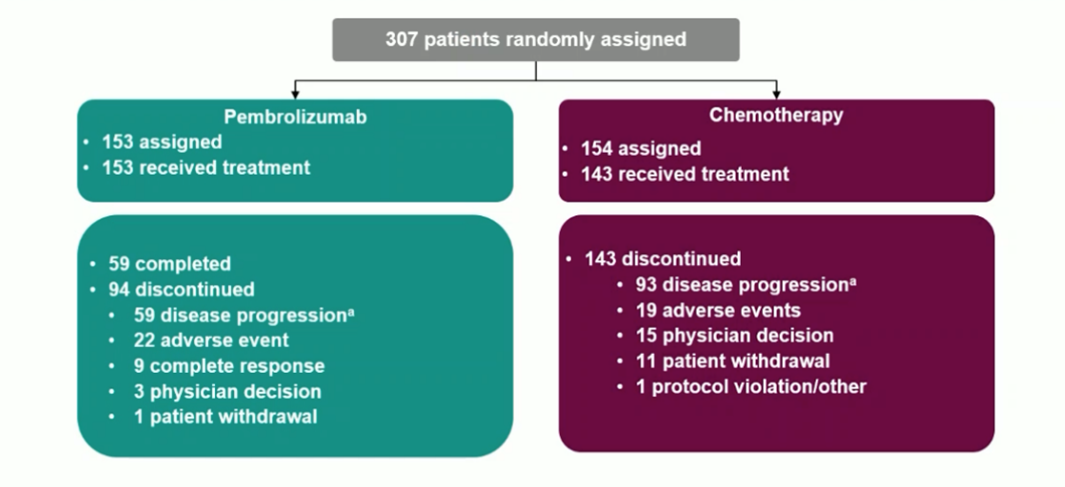
图2 患者分配
数据分析显示,帕博利珠单抗组和化疗组的中位OS分别为77.5个月vs 36.7个月(HR 0.73 [95% CI 0.53,0.99]),两组5年OS率分别是54.8% vs 44.2%。并且,关键亚组OS分析中,帕博利珠单抗同样优势明显。
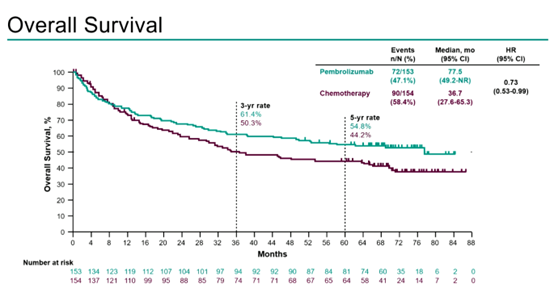
图3 OS结果
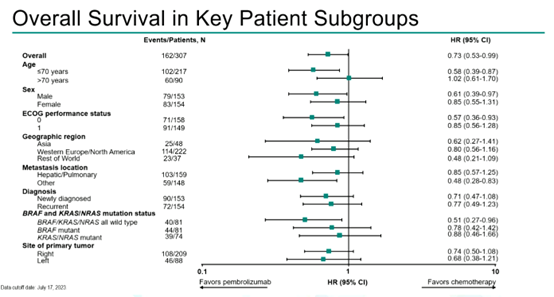
图4 关键亚组OS结果
研究还发现,帕博利珠单抗和化疗组的中位PFS分别为16.5个月vs 8.2个月(HR 0.60 [95% CI 0.45,0.79]),5年PFS率分别是34.0% vs 7.6%;并且,帕博利珠单抗组较化疗组在MSI-H/dMMR mCRC患者中具有更为持久的缓解,两组中位DOR分别是75.4个月vs 10.6个月;两组DOR≥24个月的患者分别为85.7% vs 33.6%。
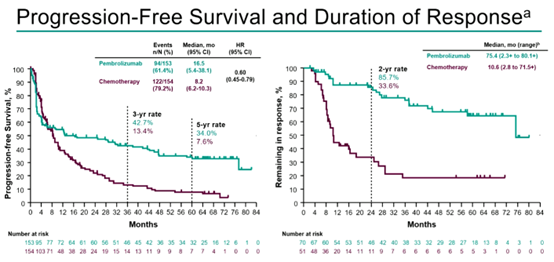
图5 PFS与DOR结果
治疗相关不良事件(TRAEs)发生率分别为79.7% vs 98.6%,3-5级TRAEs发生率分别为21.6% vs 67.1%。
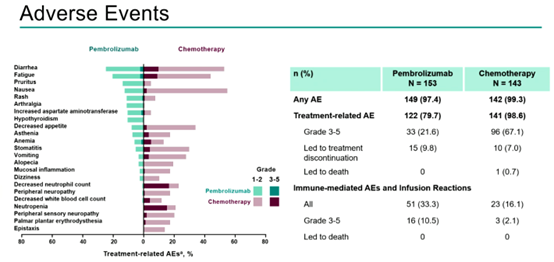
图6 安全性结果
研究结论
经过5年随访,帕博利珠单抗较化疗在MSI-H/dMMR mCRC患者中具有更为持久的缓解。尽管62%的化疗患者后来接受了免疫治疗,但帕博利珠单抗组仍有改善OS的趋势。这进一步支持了帕博利珠单抗作为MSI-H/dMMR mCRC患者的一线标准治疗。
专家锐评

数据显示,MSI-H结直肠癌约占所有结直肠癌患者的10%-15%。早中期 MSI-H 结直肠癌预后较好,但晚期患者预后较差,对化疗不敏感。PD-1抑制剂的出现显著改变了该人群的预后和治疗格局,不仅在后线治疗获得良好疗效,而且在一线治疗中疗效也显著优于传统的化疗联合靶向治疗2。
KEYNOTE-177研究是一项多中心、随机对照、开放性3期临床研究,评估了帕博利珠单抗单药对比化疗±靶向药物一线治疗MSI-H/dMMR mCRC的疗效和安全性。该研究在2020年6月的ASCO年会上首次以重磅研究摘要的形式惊艳亮相。该研究显示,一线治疗使用帕博利珠单抗相较于化疗显著延长MSI-H/dMMR mCRC患者的PFS。KEYNOTE-177研究改变了晚期结直肠癌一线治疗的格局。2022年5月,KEYNOTE-177研究荣登LANCET,报告了该研究的最终生存分析,与化疗相比,帕博利珠单抗仍显示出持久的抗肿瘤活性和较好的安全性。这些发现支持帕博利珠单抗作为MSI-H/dMMR mCRC患者的一线治疗选择1,2。本次KEYNOTE-177研究登陆ESMO舞台,再次力证其卓越疗效。研究结果提示,经过5年随访,帕博利珠单抗组和化疗组的中位OS分别为77.5个月vs 36.7个月(HR 0.73 [95% CI 0.53,0.99]),两组5年OS率分别是54.8% vs 44.2%;中位DOR分别是75.4个月vs 10.6个月。帕博利珠单抗较化疗在MSI-H/dMMR mCRC患者中具有更为持久的缓解。众所周知,精准治疗的前提是找到对应靶点,而通过分子标志物来筛选获益人群,则是另一个重要层面。在CRC诊疗过程中,MSI/dMMR的检测结果可以有效提示临床医生如何选择更优的治疗方案,即当发现CRC患者带有MSI-H/dMMR这一“标签”时,就会想到免疫治疗的可能性。另外,值得注意的是,尽早使用PD-1单抗不仅可能提高治愈的人群比例,而且还能够使部分患者避免接受化疗,以达到降低治疗毒性、改善生活质量,同时降低医疗资源的耗费。

研究背景
结直肠癌的原发肿瘤位置(PTL)越来越受到关注,并已证明右半结肠癌(RCC)与左半结肠癌(LCC)在流行病学、临床和组织学特征上有显著差异。研究发现,右半结肠癌似乎比左半结肠癌和直肠癌恶性程度高且易复发。PTL已被证实在结直肠癌(CRC)的一线治疗中具有明确的预后预测价值,但其对难治性CRC的影响尚不明确。2023欧洲肿瘤内科学会(ESMO)年会公布一项真实世界多中心回顾性研究,旨在评估PTL对瑞戈非尼、TAS-102序贯治疗晚期≥3线转移向结直肠癌(mCRC)预测及预后的影响3。
研究设计
研究回顾性收集了2012年7月~2022年3月来自13家意大利癌症研究所接受瑞戈非尼和/或TAS-102治疗的诊断为mCRC患者的临床数据。根据RCC或LCC将患者分为两组。亚组分析包括接受瑞戈非尼序贯TAS-102组(R+T)和TAS-102序贯瑞戈非尼组(T+R)。在真实世界中评估PTL对瑞戈非尼和/或TAS-102治疗患者总生存期(OS)、无进展生存期(PFS)和疾病控制率(DCR)的影响。
研究结果
研究共纳入866例患者,146例(16.8%)接受T+R治疗,116例接受R+T治疗,325例(37.5%)接受TAS-102单药治疗,279例(32.5%)接受瑞戈非尼单药治疗。患者中位年龄为68岁,中位随访时间为7.2个月,ECOG PS=0~1。
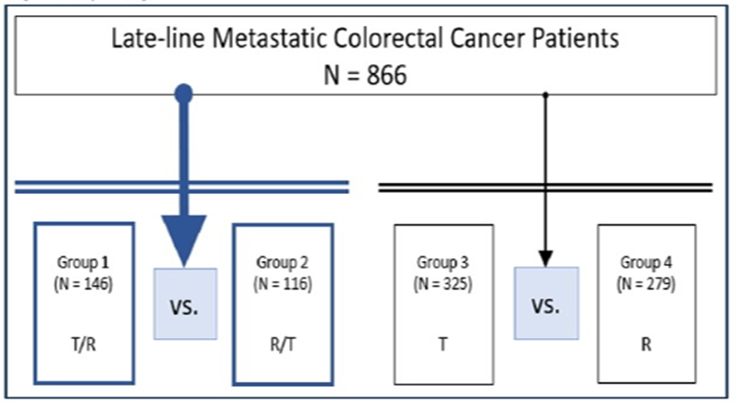
本研究特别关注接受T+R治疗和逆序接受R+T治疗的患者。在T+R组发现52例RCC和94例LCC患者,而在R+T组发现34例RCC和82例LCC患者。两组患者均出现≥2个转移灶(T+R 80%,R+T 51%,P=0.4406)。
其中LCC患者较RCC患者OS更优。在LCC患者中,R+T组患者中位OS在数值上长于T+R组(16.8个月vs 14.7个月;HR=0.57,95%CI 0.36~0.90,P=0.0569)。
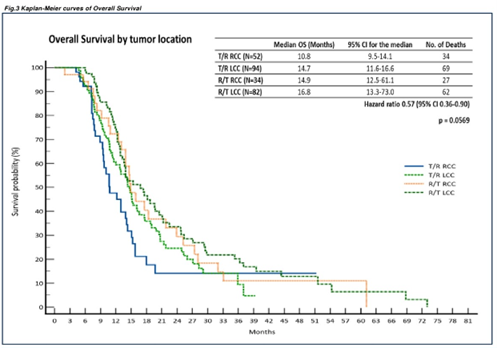
图2 OS数据
LCC与RCC患者PFS无显著差异,但LCC患者中R+T组患者的PFS较T+R组显著延长(11.7个月 vs 9.1个月;HR=0.49,95%CI 0.32~0.76,P=0.0022)
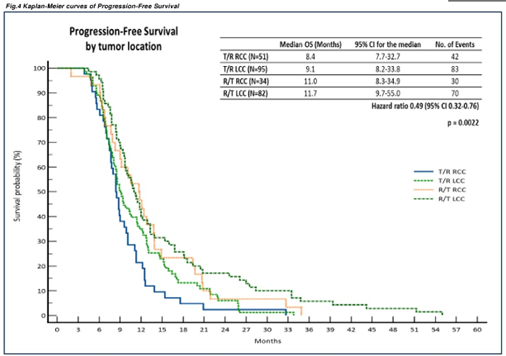
图3 PFS数据
PTL对患者的DCR无显著影响,LCC患者中R+T组和T+R组患者的最佳DCR均为34.8%(P=0.4904)。此外,R+T组的ORR为5%,优于T+R组的2.9%。
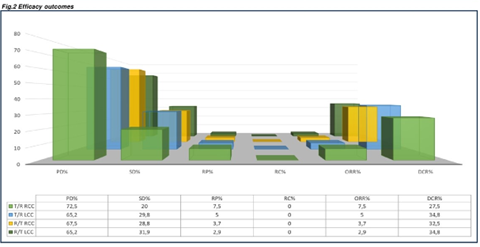
图4 ORR DCR数据
研究结论
此项真实世界研究中,瑞戈非尼和TAS-102的使用顺序能够影响难治性mCRC患者的预后,R+T较T+R治疗有更好的OS和PFS获益。但未来仍需要进一步的研究进行验证。
专家锐评

晚期结直肠癌二线标准治疗之后,仍有较多患者可以接受三线及后线的治疗,以进一步延长总生存。因此,三线及后线治疗的排兵布阵对于患者生存时间和生存质量有很大的影响。目前晚期CRC已获指南推荐的三线标准治疗药物包括瑞戈非尼、呋喹替尼、TAS-1024。其中,瑞戈非尼是一种多靶点激酶抑制剂,也是晚期CRC三线治疗中应用最早且研究数据最多的一个治疗方案。目前已有多项研究证实,三线使用瑞戈非尼治疗后再用其他疗法能够给患者带来明显的生存获益。
2023年ASCO GI会议报告了一项瑞戈非尼和TAS-102序贯后线治疗难治性mCRC的多中心回顾性研究,研究结果显示,在匹配的人群中,瑞戈非尼序贯TAS-102组与TAS-102序贯瑞戈非尼组的中位PFS分别为11.0个月vs 8.5个月(p=0.0014),中位OS分别为14.9个月vs 13个月(p=0.0296)5。此项2023 ESMO报告的临床数据显示,瑞戈非尼序贯TAS-102组与TAS-102序贯瑞戈非尼组的中位PFS分别为11.7个月 vs 9.1个月(P=0.4406),中位OS分别为16.8个月vs 14.7个月(P=0.0022)3。再次验证了瑞戈非尼序贯TAS-102较TAS-102序贯瑞戈非尼具有更长生存获益的结论。
此外,来自中国北京大学肿瘤医院的一项双向观察性队列研究显示,瑞戈非尼序贯呋喹替尼较呋喹替尼序贯瑞戈非尼,患者生存获益更大。该研究纳入366例接受瑞戈非尼(260例)或呋喹替尼(106例)治疗的转移性结直肠癌患者,结果显示瑞戈非尼序贯呋喹替尼中位OS为 28.1个月, 呋喹替尼序贯瑞戈非尼的中位OS为18.4个月(p=0.024)6。总而言之,从目前现有的循证医学证据来看,三线治疗首选瑞戈非尼对患者获益更为明显。希望在此基础上,有更多的大型随机对照临床研究进一步探索mCRC三线治疗的排兵布阵,为患者带来更多希望。

研究背景
瑞戈非尼(REG)和曲氟尿苷/盐酸替匹嘧啶(TAS-102)已经获批用于治疗难治性转移性结直肠癌(mCRC)。然而,在体能状况允许的情况下连续使用这两种药物的最佳顺序尚未在随机研究中进行评估,目前数据仅限于荟萃分析或观察性研究,且结果不一。瑞戈非尼与TAS-102具有不同的作用机制和安全性特征,因此,患者的基线特征、合并症和药物各自的安全性特征是这两种药物排序时需要考虑的潜在因素。本研究旨在评估在美国社区临床实践中接受序贯治疗的mCRC患者的特征和临床结局,其结果于2023年欧洲肿瘤内科学会(ESMO)年会公布7。
研究设计
这项回顾性队列研究使用的是全美国范围内去除身份识别的Flatiron Health电子健康记录衍生数据库。2015年1月到2022年9月期间诊断为mCRC的18岁患者分为两个队列,分别接受REG和TAS-102±贝伐珠单抗(Bve)序贯治疗:R-T(REG后接受TAS-102±Bve治疗)和T-R(TAS-102±Bve后接受REG治疗)。最短随访时间为3个月。研究终点包括总生存期(OS)、至治疗终止时间(TTD)、中性粒细胞减少率和粒细胞集落刺激因子(G-CSF)的使用情况。
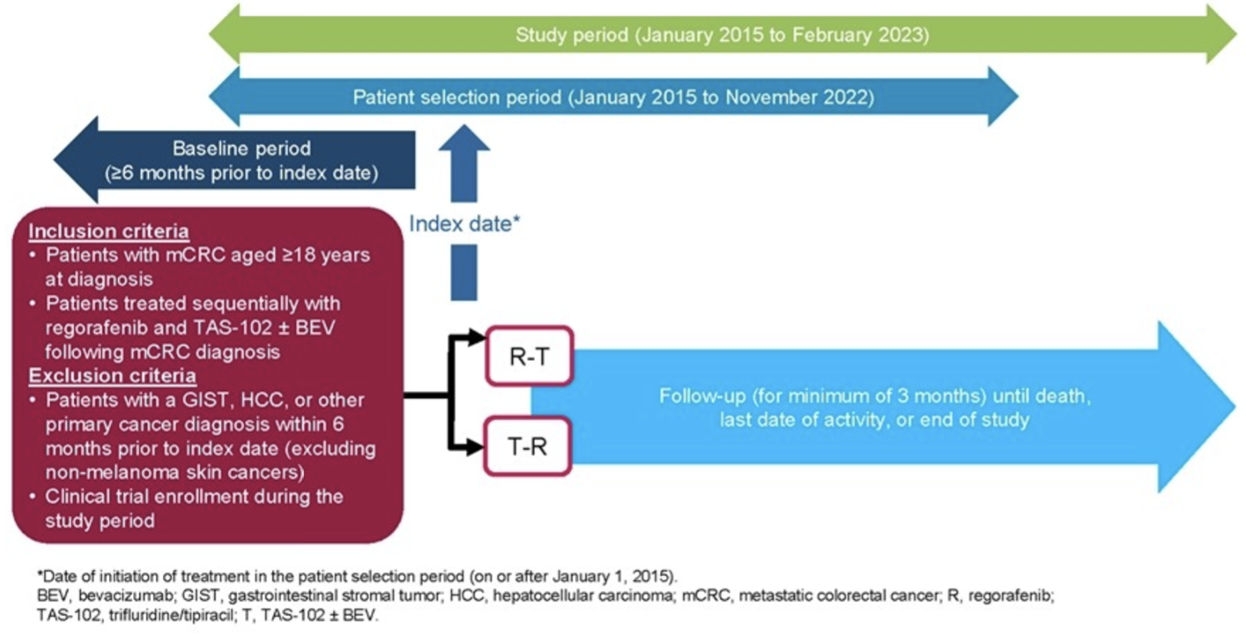
图1 研究设计
研究结果
研究共纳入818例患者(R-T队列:n=393;T-R队列:n=425)。大多数患者在3L(41.9%)或4L(23.7%)时接受指定治疗。各组之间患者基线特征相似。结果显示,在3L和4L组中,与T-R队列相比,R-T队列的中位OS均获得改善(3L组:13.1个月 vs 11.5个月;4L组:11.6个月 vs 10.3个月),但差异无统计学意义(3L组HR=0.94,95%CI:0.74-1.19;4L组HR=0.86,95%CI:0.63-1.18)。
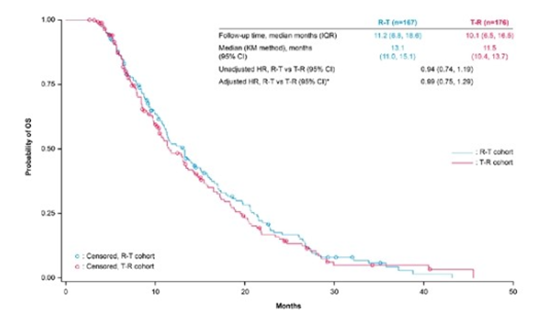
图2 3L组R-T队列和T-R队列的OS数据
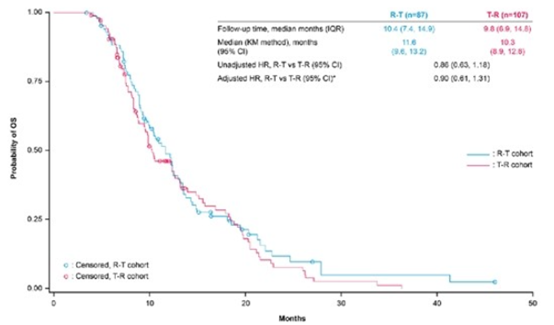
图3 4L组R-T队列和T-R队列的OS数据
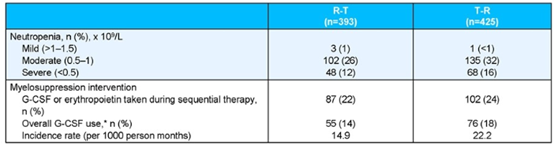
在3L组和4L组中,R-T队列的TTD均略长于T-R队列,3L组分别为8.7个月和8.1个月(HR=0.91,95%CI:0.73-1.14);4L组分别为8.5个月和7.9个月(HR=0.86,95%CI:0.63-1.16)。R-T队列中性粒细胞减少率和G-CSF的使用率均低于T-R队列(两队列中性粒细胞减少率分别为38.9% vs 48.0%;G-CSF使用率分别为14.0% vs 17.9%)。
表1 3L组和4L组R-T队列和T-R队列的TTD数据
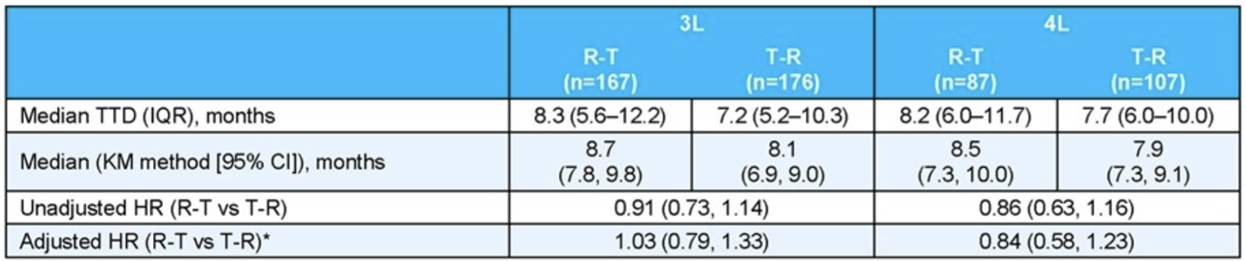
表2 R-T队列和T-R队列的中性粒细胞减少和G-CSF使用情况
研究结论
这项真实世界研究表明,与T-R治疗相比,接受序贯R-T治疗的患者似乎具有更长的OS和TTD,以及更低的中性粒细胞减少率和G-CSF使用率。从REG开始的序贯疗法可为难治性mCRC患者提供化疗间歇期,改善耐受性并减少骨髓抑制。在两组患者中,约有三分之一的患者继续接受进一步治疗,表明不同的序贯治疗方式不会影响接受后续治疗的机会。
专家锐评

瑞戈非尼是首个被批准用于mCRC三线治疗的小分子多激酶抑制剂,这主要基于CORRECT研究8的阳性结果。CORRECT研究是一项全球多中心、随机对照III期临床研究,纳入了760例经一线、二线标准治疗失败的结直肠癌患者。最终该研究达到主要终点,瑞戈非尼组患者中位OS明显长于安慰剂组(6.4个月 vs 5.0个月,P=0.0052),且安全性良好。TAS-102获批用于治疗难治性mCRC患者是基于III期RECOURSE研究9的结果,TAS-102组相对安慰剂实现了显著的生存获益,其中位OS为7.1个月,较安慰剂组延长了1.8个月。这两药已经成为难治性mCRC患者的标准三线治疗方案,但两药单独使用为患者带来的获益仍然有限,为优化难治性mCRC三线及以上治疗方案,不同药物组合的联合治疗和序贯治疗方案展开探索。
在联合治疗的相关临床研究中,SUNLIGHT研究10表明,与单独使用TAS-102相比,TAS-102联合贝伐珠单抗明显延长了难治性mCRC患者的OS(中位OS分别为10.8个月和7.5个月),降低患者死亡风险39%。这也为序贯治疗的探索提供了思路。
目前来说,瑞戈非尼与TAS-102的序贯治疗数据有限,因此本研究评估了在美国社区临床实践中接受瑞戈非尼与TAS-102±贝伐珠单抗序贯治疗的mCRC患者的特征和临床结局,结果表明,与TAS-102±贝伐珠单抗序贯瑞戈非尼治疗相比,接受瑞戈非尼序贯TAS-102±贝伐珠单抗治疗的患者具有更长的OS和TTD,以及更低的中性粒细胞减少率和G-CSF使用率1。这项研究不仅为难治性mCRC患者的三线治疗提供了具有潜力的序贯治疗方案,而且同时减少了骨髓移植,改善患者的耐受性。

研究背景
大约 15-20% 的晚期胃或胃食管结合处(G/GEJ)腺癌存在HER2过表达。新型抗体药物偶联物(ADC)德曲妥珠单抗(T-DXd)的出现开启了HER2阳性晚期G/GEJ腺癌的ADC治疗新时代。DESTINY-Gastric01研究探讨了T-DXd在日本和韩国晚期HER2阳性G/GEJ腺癌≥3线治疗的疗效和安全性。2023年6月,DESTINY-Gastric02研究结果全文发表于《柳叶刀·肿瘤学》(The Lancet Oncology,IF:51.1),进一步评估了T-DXd在欧美HER2阳性晚期G/GEJ腺癌2线治疗的疗效和安全性11。
研究设计
cORR结果
DESTINY-Gastric02是一项在美国和欧洲24家研究中心的成人患者中开展的单臂、2期研究。患者纳入标准为:1)≥18岁,ECOG PS评分0或1,经病理证实不可切除或转移性晚期G/GEJ腺癌;2)含曲妥珠单抗方案一线治疗期间或之后疾病进展;3)根据RECIST V1.1评估标准,至少存在一个可测量病灶;4)经中心实验室验证为HER2阳性患者(定义为IHC3+或IHC2+/ISH+)。患者每3周静脉给予6.4 mg/kgT-DXd,直至疾病进展、退出试验或死亡。主要终点为独立中心审查委员会 (ICR) 评估的经确认的客观缓解率(cORR)。
研究结果
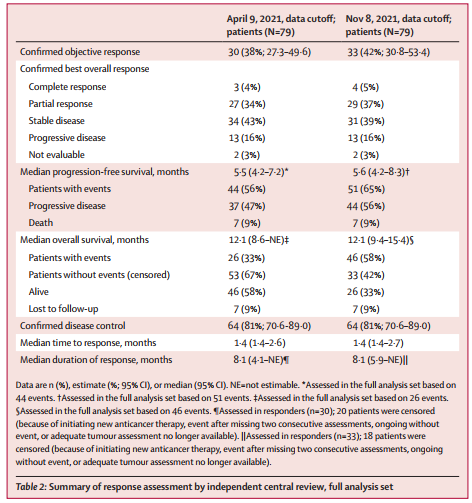
研究者共筛选了89例患者,其中79例患者入组并接受至少一剂T-DXd治疗。在主要分析中,截至2021年4月(中位随访5.9个月[IQR 4.6个月~8.6个月]),经ICR评估,30例患者(38%[95% CI 27.3~49.6])达到cORR,其中3例(4%)完全缓解(CR),27例(34%)部分缓解(PR)。
在更新分析中,截至2021年11月(中位随访10.2个月[IQR 5.6个月~12.9个月]),经ICR评估,有33例(42%[95% CI 30.8~53.4])达到cORR,其中4例(5%)CR,29例(37%)PR。
表1 经ICR评估的患者反应
PFS、OS、DOR结果
在更新分析中,经ICR评估的患者中位缓解持续时间(DOR)为8.1个月(95% CI,5.9-NE),中位PFS为5.6个月(95% CI,4.2-8.3),中位OS为12.1个月(95% CI,9.4-15.4)。
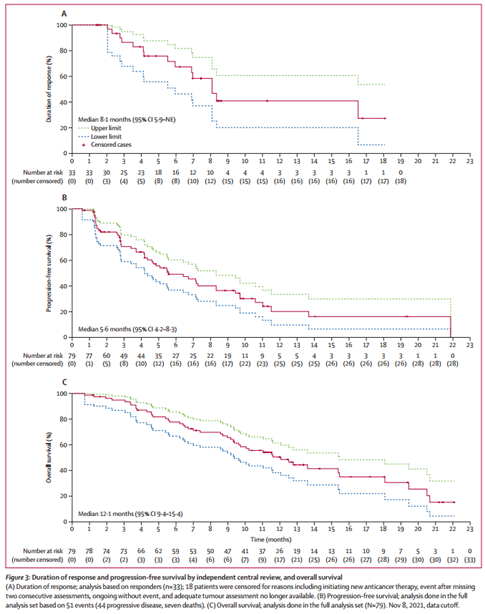
图1 患者DOR(A)、PFS(B)、OS(C)数据
安全性数据
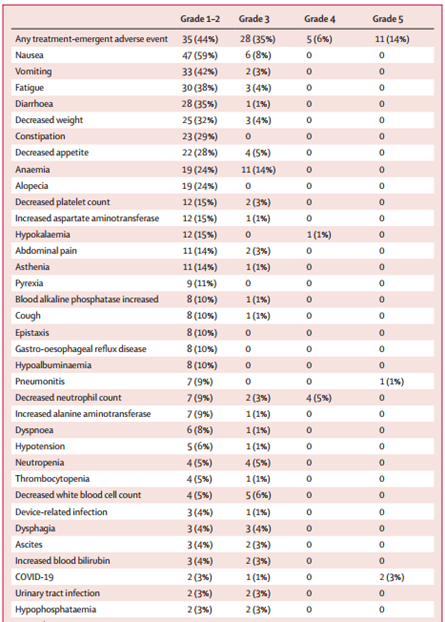
在安全性分析集中,中位治疗持续时间为4.3个月。所有患者均出现治疗紧急不良事件(TEAE),其中56%的患者出现 ≥3级TEAE,42%的患者出现严重TRAE。大多数患者(95%)报告了药物相关的 TEAE,最常见的1级或2级TEAE包括恶心(59%)、呕吐(42%)、疲劳(38%)和腹泻(35%)。10%的患者发生与研究药物相关的间质性肺疾病(ILD)/肺炎,多为1~2级。共有14%的患者发生死亡事件,其中2例死于ILD/肺炎。
表2 治疗紧急不良事件(发生率≥5%)
研究结论
DESTINY-Gastric02研究数据支持T-DXd作为HER2阳性晚期G/GEJ腺癌患者的二线治疗。
专家锐评

HER2的过表达在胃癌中约占15%-20%,是胃癌唯一的精确治疗位点。临床实践中,HER2阳性表达偏低,可能与HER2阳性检测率不高有关。ToGA试验是全球第一个证明靶向治疗能延长晚期胃癌生存时间的大型III期临床试验,使得曲妥珠单抗成为了第一个在胃癌上成功应用的靶向药物,具有里程碑式的意义12。之后很长一段时间没有较好的HER2靶向治疗药物出现。T-DXd的出现让临床医生眼前一亮,T-DXd由与曲妥珠单抗一致的抗体、拓扑异构酶Ⅰ抑制剂DXd和可裂解连接子组成,其载体活性高,且具有旁观者效应。DESTINY-Gastric01是第一个证实T-DXd临床获益的随机对照Ⅱ期研究,结果显示,T-DXd三线治疗HER2阳性(IHC3+或IHC 2+和ISH+)G/GEJ腺癌患者的ORR高达51.3%,中位PFS和OS分别为5.6个月和12.5个月13。此外,DESTINY-Gastric01研究也对HER2低表达人群进行了探索,T-DXd对于HER2低表达队列1(HER2 IHC 2+/ISH-)和队列2(HER2 IHC 1+)患者的ORR分别达到26.5%和9.5%,这提示T-DXd可抑制HER2低表达G/GEJ腺癌的肿瘤生长14。
DESTINY-Gastric02在DESTINY-Gastric01研究的基础上进一步扩展了人群,补充了西方人群样本空白,结果显示在欧美HER2阳性G/GEJ腺癌患者中,T-DXd表现出有意义的临床活性和可控的安全性,患者经确认的ORR达到42%,中位PFS和OS分别为5.6个月和12.1个月11。获得了与DESTINY-Gastric01研究一致的临床获益。另外,DESTINY-Gastric02研究进一步将T-DXd的使用扩展到二线治疗的HER2阳性G/GEJ腺癌患者。目前在欧美人群中,T-DXd二线治疗的临床疗效尤具前景。T-DXd已经在日本、美国、欧盟获批HER2阳性晚期G/GEJ腺癌患者治疗的适应症,同时纳入了NCCN 、ESMO、 CSCO等多项指南推荐。期待后续研究结果的更新推动T-DXd适用人群的扩大。
DESTINY-Gastric02研究也存在局限性,DESTINY-Gastric02研究为单臂研究,未来需要进一步的随机对照研究证实其可靠性,目前T-DXd二线治疗HER2阳性晚期G/GEJ腺癌患者DESTINY-Gastric04随机对照研究正在进行中,期待其研究结果公布,为HER2阳性晚期G/GEJ腺癌患者的二线治疗提供更好的选择。
参考文献:
1. Shiu KK, et al.Pembrolizumab versus chemotherapy in microsatellite instability-high (MSI-H)/mismatch repair-deficient (dMMR) metastatic colorectal cancer (mCRC): 5-year follow-up of the randomized phase III KEYNOTE-177 study .2023 ESMO LBA32.
2. 丁培荣. 微卫星高度不稳定结直肠癌的免疫治疗. 中华胃肠外科杂志.2022;25(3):199⁃204.
3. Signorelli C,et al. Predictive and prognostic impact of primary tumor location on sequential treatment with regorafenib and trifluridine/tipiracil at third line and beyond in metastatic colorectal cancer: A real-world multicenter retrospective analysis. 2023 ESMO e-poster 617P.
4. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2023. 北京:人民卫生出版社,2023.
5. Signorelli C, et al. Sequential treatment with regorafenib and trifluridine/tipiracil in later-line refractory metastatic colorectal cancer: A real-world multicenter retrospective study. 2023 ASCO GI.Abstract 45.
6. Zhang Q,et al. Efficacy and Safety Comparison of Regorafenib and Fruquintinib in Metastatic Colorectal Cancer-An Observational Cohort Study in the Real World. Clin Colorectal Cancer. 2022;21(3):e152-e161.
7. Tanios S,et al. Sequential treatment with regorafenib and trifluridine/tipiracil ± bevacizumab in refractory metastatic colorectal cancer in community clinical practice in the USA. 2023 ESMO Abstract 616P.
8. Grothey A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013 Jan 26;381(9863):303-12.
9. BRUIXJ,et al:Regorafenibfor patients with hepatocellular carcinoma who progressed onsorafenib treatment(RESORCE): a randomised, double-blind,placebo-controlled, phase 3 trial. Lancet. 2017; 389 (10064):56-66.
10. Tabernero J, Taieb J, Prager GW, et al. Trifluridine/tipiracil plus bevacizumab for third-line management of metastatic colorectal cancer: SUNLIGHT study design. Future Oncol. 2021 Jun;17(16):1977-1985.
11. Van Cutsem E,et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol. 2023 Jul;24(7):744-756.
12. Bang YJ, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
13. Shitara K,et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med. 2020;382(25):2419-2430.
14. Yamaguchi K,et al. Trastuzumab Deruxtecan in Anti-Human Epidermal Growth Factor Receptor 2 Treatment-Naive Patients With Human Epidermal Growth Factor Receptor 2-Low Gastric or Gastroesophageal Junction Adenocarcinoma: Exploratory Cohort Results in a Phase II Trial. J Clin Oncol. 2023;41(4):816-825.
