GI医声 第9期 I 立足精准,持续探索,助力结直肠癌治疗优化
医脉通 2023.12.17

GI 医声
13条内容

导读:结直肠癌是常见的消化道恶性肿瘤之一,其发病率和死亡率居高不下。随着肿瘤分子生物学和精准医学的不断进步,对于肿瘤发生和发展背后的分子和基因改变的认识越来越深入,为精准治疗提供了新的思路,为患者带来了更好的疗效。在此背景下,本期GI医声特邀佛山市第一人民医院王巍教授、福建医科大学附属第一医院王日雄教授、苏州大学附属第一医院朱虹教授、湖州市中心医院潘月芬教授分享结直肠癌领域的前沿进展,揭示这些研究可能为结直肠癌患者带来的希望和突破。

研究背景
HER2是转移性结直肠癌(mCRC)的驱动生物标志物,尽管HER2扩增/过表达(HER2阳性)在所有mCRC患者中的发生率为3%~5%,但在RAS/BRAF野生型mCRC患者中却高达10%1。根据MOUNTAINEER研究结果,2023年1月,FDA批准图卡替尼与曲妥珠单抗联合用于既往治疗过的RAS野生型HER2阳性mCRC。2023年欧洲肿瘤内科学会(ESMO)年会报告了基线基因改变对图卡替尼临床活性的影响2。
研究设计
MOUNTAINEER研究招募了经组织免疫组化(IHC),荧光原位杂交(FISH)和/或二代测序(NGS)评估为HER2阳性的mCRC患者。使用IHC/FISH,PGDx组织NGS和Guardant 360血液NGS对基线组织和血液标本进行回顾性分析。针对图卡替尼治疗的≥5例患者中发生的特定基因异常(单核苷酸变异[SNVs]和拷贝数变异[CNVs]),计算确认的客观反应率(cORR,盲态独立中心审查委员会 [BICR] 根据RECIST v1.1评估)及反应持续时间(DOR)。该分析为描述性,未进行统计学比较。
研究结果
共纳入84例患者接受图卡替尼治疗的患者,其中65例可行FISH检测。结果显示,HER2扩增程度越大,cORR数值越高,不论是使用HER2/CEO17比值(>5, n=50: cORR[95%CI]=44.0%[30.0, 58.7];≤5, n=15: cORR [95%CI]= 26.7% [7.8, 55.1]),还是HER2拷贝数进行测量(>9.45, n=57: cORR [95%CI]=42.1% [29.1, 55.9];≤9.45, n=8: cORR [95%CI]=25.0% [3.2, 65.1])。患者组织(n=45)和血液(n=66)样本NGS检测结果发现的伴随关键基因突变和/或基因扩增包括ERBB2,PIK3CA,APC和TP53。这些患者的cORR和DOR和总人群类似。
表1 伴随基因异常患者的cORR和DOR
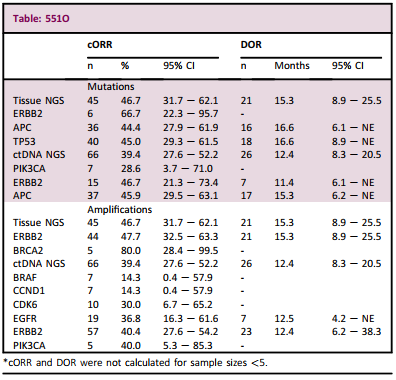
研究结论
此项MOUNTAINEER研究的探索性分析发现,图卡替尼在对HER2阳性RAS野生型mCRC患者亚组和其他具有临床相关基因异常患者初步分析中,具有一致临床疗效。
专家锐评

约 30%~40% 的患者初诊时即为晚期结直肠癌,并且相当一部分局限期患者根治术后仍会出现复发或转移,而晚期结直肠癌患者 5 年生存率仅有 12%3。随着近些年来对结直肠癌分子机制的研究,分子靶向药物及免疫治疗进展迅速,为携带少见突变的结直肠癌提供更精准和更有效的治疗手段及方案。人表皮生长因子受体 2( HER2)是一种肿瘤标志物,可加快新生血管形成,与肿瘤侵袭能力、转移速度有关,HER-2也已确定为一种可成药靶点之一。近年来, 抗 HER2 的靶向药物不断推陈出新,不仅在乳腺癌、胃癌中大放异彩,也给 HER2 阳性结直肠癌治疗带来新希望。
图卡替尼是一种新型的高选择性的 HER2 小分子酪氨酸激酶抑制剂,可以抑制表皮生长因子受体或其他相关受体,且能有效通过血 -脑脊液屏障。MOUNTAINEER研究已经证明图卡替尼联合曲妥珠单抗在既往接受过治疗的HER2扩增RAS野生型难治性mCRC患者中疗效显著且安全性可控,ORR达到38.1%1。HER2作为mCRC患者一种临床相关的生物标志物,基线伴随其他基因异常对治疗的影响尚不清楚。2023 ESMO大会公布了MOUNTAINEER研究探索性分析结果,结果显示基线伴随基因异常对图卡替尼+曲妥珠单抗治疗HER2阳性结直肠癌疗效无显著影响。但由于该研究为描述性研究,未进行统计学比较,仍需要进一步的研究证实这一结论。
未来仍需要更多的研究证据进一步揭示抗HER2治疗在mCRC患者中的具体机制,以提供更合理的抗HER2治疗策略为HER2阳性CRC患者带来更多生存获益。

研究背景
I-II期研究中,抗EGFR抗体联合三药化疗方案对于RAS/BRAF野生型(WT)肿瘤退缩显示出具有前景的效果。超敏循环DNA(cirDNA)分析可能会更好地选择对于抗EGFR治疗具有超应答的患者。因此,PANIRINOX研究的目的是明确在基于cirDNA的RAS/BRAF V600E WT不可切除转移性结直肠癌(mCRC)患者中,帕尼单抗(P)联合三药化疗(FOLFIRINOX,A组)或标准双药化疗(mFOLFOX6,B组)的完全缓解(CR)率。这项随机化II期PANIRINOX-UCGI28研究的首次分析结果以LBA形式在2023年欧洲肿瘤内科学会(ESMO)年会重磅公布。
研究设计
在这项随机非对照多中心II期研究中,患者按2:1的比例分配至A/B组(最多治疗12周期),根据疾病程度分为2个不同的分层(str1:仅肝转移;str2:非仅肝转移)。主要终点是根据RECIST 1.1(中心评价)评估的CR率和CEA正常化(Fleming单步设计,单侧a=5%,b=10%,H0:3%;H1:12%;A组60例患者至少需要4例成功,B组作为内部对照)。次要终点包括无进展生存期(PFS)和总生存期(OS)。
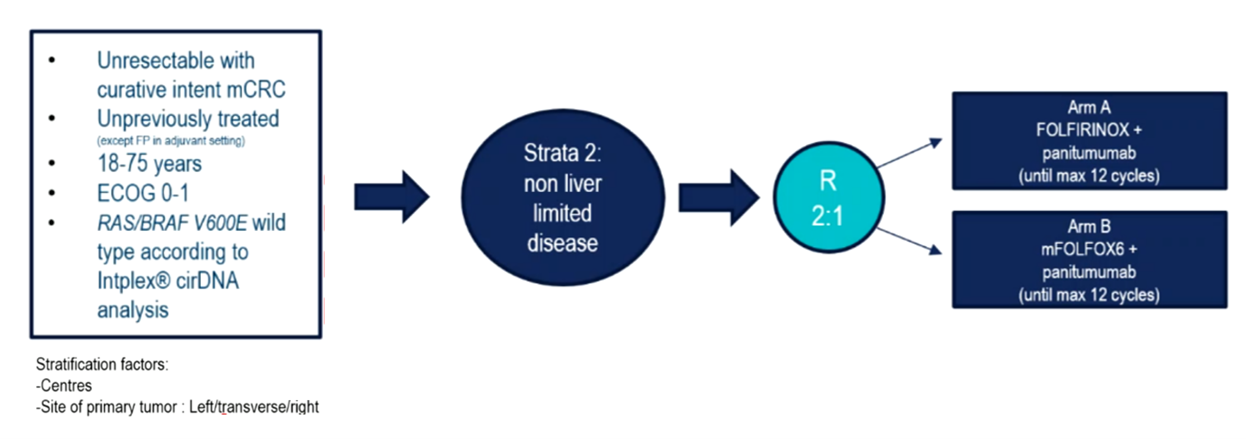
图1 研究设计
研究结果
从2017年10月到2022年7月,78/33例患者被分配到str2的A/B组。主要特征为(A/B组):中位年龄64/62岁;男性67%/45%;PS 0分63%/42%;左半81%/79%;同时性转移85%/87%;>1处转移灶82%/72%。可评估患者的CR率见表1,PFS和OS结果见图2。
表1 可评估患者的CR率
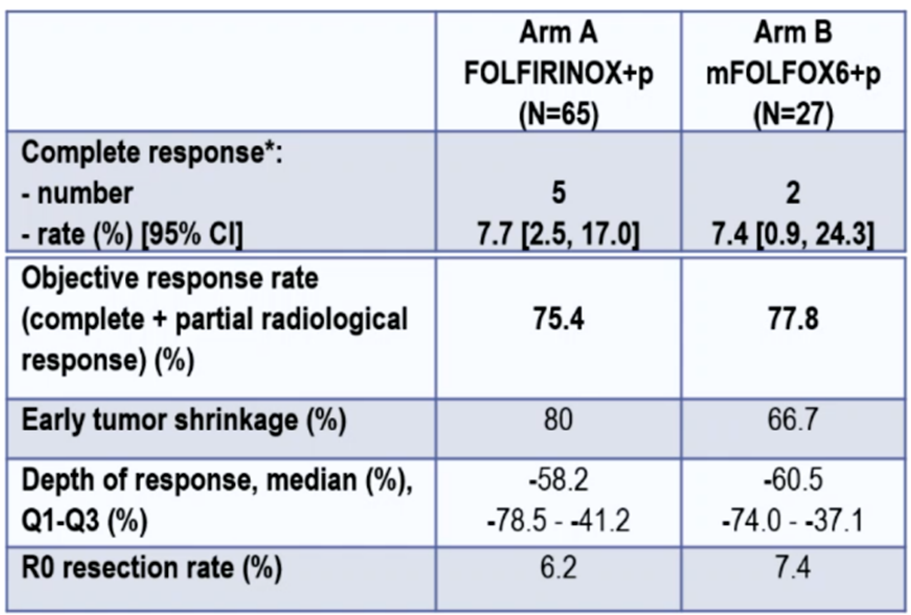
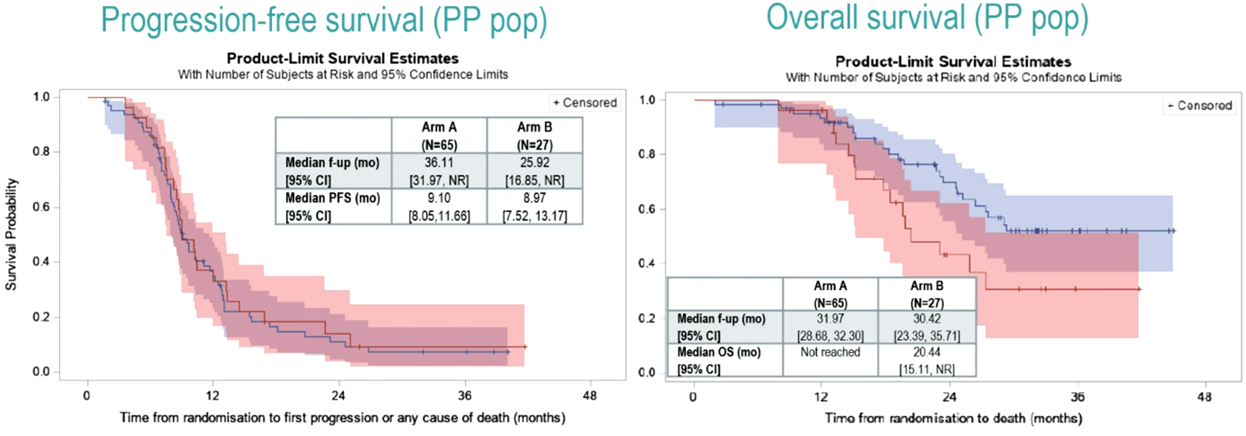
图2 可评估患者的PFS、OS结果
安全性方面,主要≥3级治疗相关不良事件为(A/B组):腹泻39%/9%,周围神经病变22%/24%,皮肤反应18%/24%。
研究结论
在A组中有5例患者达到CR,在B组中95%CI区间包含预先设定的假设值,该研究在str2中达到了主要终点。PANIRINOX-UCGI28研究证实,在一线使用抗EGFR治疗之前,通过cirDNA分析对肿瘤进行基因分型是一种有效的组织检测的替代手段。
专家锐评

近年来,随着系统治疗的不断发展,mCRC患者的生存得到了明显的改善。除了化疗,靶向治疗、免疫治疗以及多种药物治疗也已经百花齐放,治疗手段愈加丰富,这也对精准治疗提出了更高的要求。
循证证据表明,CRS评分、原发肿瘤部位、基因状态都是影响患者生存的重要因素。而mCRC的肿瘤生物学行为可以影响其对药物的敏感性,比如,RAS/BRAF WT左半mCRC优选抗EGFR单抗联合化疗,右半mCRC可以通过抗EGFR单抗联合治疗转化,使不可切除肿瘤变为可切除。无论是之前的CALGB80405研究4、FIRE-3研究5,还是来自真实世界的数据,都表明抗EGFR单抗联合双药化疗是RAS/BRAF WT左半mCRC的最佳选择,患者不仅有远期OS的明显获益,也有很好的近期获益。以转化为目的治疗时,若患者身体条件合适,还可以选择抗EGFR单抗联合三药化疗。
为了筛选获益人群,探索更加个体化的治疗方案,有研究6发现,利用cirDNA检测法对mCRC肿瘤进行基因分型(RAS/BRAF V600E状态测定)具有临床有效性和实用性,而且可更好地筛选出对于抗EGFR治疗具有超应答的患者。PANIRINOX-UCGI28研究7由此开展,旨在明确基于cirDNA的RAS/BRAF V600E WT不可切除mCRC患者中,帕尼单抗联合三药化疗(FOLFIRINOX)或标准双药化疗(mFOLFOX6)的CR率,研究在str2中达到了主要终点,A组的60例随机患者中有5例实现CR,提示帕尼单抗联合三药化疗方案在str2分层中具有明显疗效。
然而,除了OS数据外,两组治疗方案的结果在数值上并无差异,因此并不支持对RAS/BRAF V600E WT广泛转移性疾病患者前期使用抗EGFR单抗联合强化化疗方案,尤其是在分子水平上经过严格筛选的情况下。之前TRIPLETE II期研究已经证明了这一点(TRIPLETE研究未达到主要终点,mFOLFOXIRI+帕尼单抗未能改善患者的客观缓解率[ORR],两组间的R0切除率和PFS也未见显著差异)。但PANIRINOX-UCGI28研究中肝脏局限性疾病的分层结果仍然值得期待。

研究背景
瑞戈非尼是一种口服小分子多激酶抑制剂,在阻断肿瘤血管生成、抑制肿瘤侵袭转移、促进机体抗肿瘤免疫、改善肿瘤微环境中发挥多重作用。2017年3月,瑞戈非尼正式在华上市,用于既往接受过标准治疗的转移性结直肠癌(mCRC)患者,批准剂量使用为 160mg(4x40mg),每日一次,连续给药3周,停药1周,4周为一个周期。然而,基于ReDOS研究结果(Lancet Oncol,2019),瑞戈非尼起始80 mg/d,每周递增至160 mg/d的策略优于起始剂量即为160 mg/d8。然而,真实世界中,起始低剂量瑞戈非尼对治疗效果的影响尚未确定。为此,2023 ESMO 公布一项研究,探讨瑞戈非尼起始剂量对mCRC疗效的影响9。
研究方法
2013年5月~2010年12月期间,回顾性收集日本4家机构573例接受瑞戈非尼治疗的mCRC患者的临床数据,这些患者被分为两组:接受标准起始剂量组(S组,n=299,瑞戈非尼起始剂量160mg)和接受降低起始剂量组(R组,n=274,瑞戈非尼起始剂量40、80、120mg)。使用基于基线特征倾向评分调整的COX比例风险模型比较两组患者的治疗结果。倾向评分匹配后,S组和R组各有151例患者。
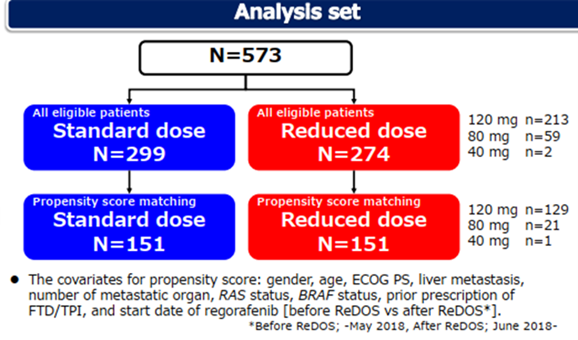
图1 研究设计
研究结果
疗效数据
S组的中位总生存期(mOS)为6.4个月,R组的mOS为6.1个月(HR 1.018,95%CI 0.807-1.283,p=0.882)。S组和R组的中位无进展生存期(mPFS)均为2.1个月(HR 1.077,95%CI 0.856-1.356,p=0.522)。
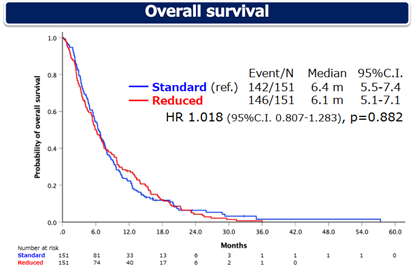
图2 OS数据
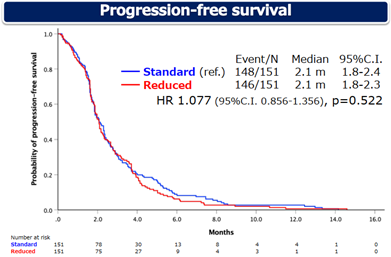
图3 PFS数据
S组首次减少剂量的中位时间为33.0天,R组为74.0天(HR 0.613,95%CI 0.447-841,p=0.002)。S组首次给药中断的中位时间为14.0天,R组为16.0天(HR 0.757,95%CI 0.581-0.987,p=0.033)。
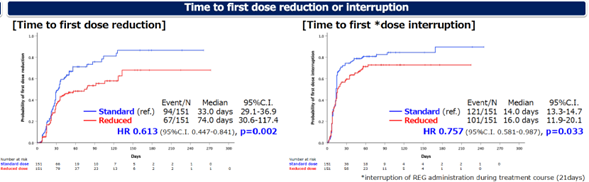
图4 首次剂量减少(左)剂量中断(右)中位时间
安全性数据
两组患者谷丙转氨酶(ALT)升高、谷草转氨酶(AST)升高、手足皮肤反应、高血压等不良反应的发生率及发病时间均无显著差异。R组任意级别和≥3级蛋白尿的发生率均显著低于S组(任意级别:68.7% vs 53.8%,p=0.027;≥3级:11.3% vs. 3.8%,p=0.045)。R组任意思级别和≥3级蛋白尿的中位发病时间显著长于S组(任意级别:HR 0.711,95%CI 0.505-1.002,p=0.042;≥3级:HR 0.338,95%CI 0.110-1.037,p=0.045)。
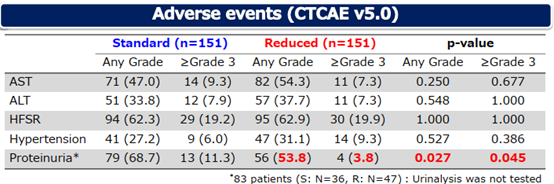
图5 任意级别和≥3级不良反应发生率
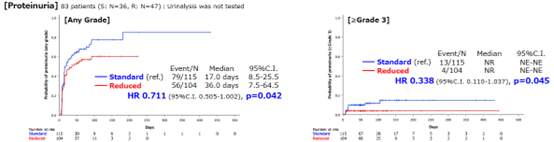
图6 任意级别(左)和≥3级(右)蛋白尿中位发病时间
研究结论
研究结果显示,降低瑞戈非尼起始剂量不影响其治疗mCRC患者的疗效,且有助于降低蛋白尿的发生率并延迟蛋白尿发生。
专家锐评

瑞戈非尼改善了mCRC患者的生存获益,但其毒副反应,如手足综合征等限制了其应用。临床医生也逐渐发现,不良事件管理是维持患者接受瑞戈非尼治疗的重要因素,实际在临床实践中已采用各种剂量调整策略。如2019年发表于Lancet Oncol的II期ReDOS研究8,该研究纳入123例mCRC患者,随机分两个瑞戈非尼剂量组:剂量递增组(起始剂量 80 mg/d,每周递增 40 mg,直至 160 mg/d,d1~21,Q28d),或标准剂量组(160 mg/d,d1~21,Q28d)。结果显示,相比标准剂量,第1周期接受剂量递增方案的患者能接受第3周期治疗的比例更高(43% vs. 25%)。剂量递增组和标准剂量组的中位PFS(2.8个月 vs 2.0个月, p=0·38)和中位OS(9.8个月 vs 6.0个月, p=0·12)相似。但剂量递增组的安全性更优。提示瑞戈非尼较低的起始剂量在不影响疗效的前提下更有具耐受性。
REGOCC-12研究是一项针对亚洲人群进行的探索,该研究是一项日本单臂、多中心、II期研究,对标准化疗后进展的mCRC 患者给予较低起始剂量瑞戈非尼方案进行了评估10。该研究给予瑞戈非尼120 mg/d,结果显示中位OS达到了10.0个月,12个月生存率为40.0%,超过了CORRECT研究11中的 24.3%。提示了以瑞戈非尼120 mg 为起始剂量的患者,仍有可能获得与160 mg为起始剂量患者相似的临床获益。中国医学科学院肿瘤医院完成周爱萍教授团队的牵头的真实世界研究显示12,以瑞戈非尼120mg为起始剂量中国患者OS获益最佳,OS最高可达16.7个月。120mg不仅能够维持有效剂量浓度,产生与160mg剂量相当的疗效;同时药物不良反应明显降低,更适合亚洲人群。
2023 ESMO发表的瑞戈非尼剂量探索研究再次证明了瑞戈非尼起始剂量降低至120mg/d更具获益/风险比,该研究降低瑞戈非尼起始剂量组120mg/d剂量的患者比例达85.4%,结果显示,降低瑞戈非尼起始剂量不影响其治疗mCRC患者的疗效,且有助于降低蛋白尿的发生率并延迟蛋白尿发生9。综合考虑,瑞戈非尼120 mg/d是比较适合中国患者的起始剂量。

研究背景
Nofazinlimab是一种靶向人程序性细胞死亡蛋白1(PD-1)的人源化重组IgG4单克隆抗体,正在开发用于肿瘤的免疫治疗。瑞戈非尼是一种多靶点酪氨酸激酶抑制剂(TKI)。已在多个国家获批用于治疗既往二线治疗失败的转移性结直肠癌(mCRC)患者。研究显示,与瑞戈非尼单药治疗相比,瑞戈非尼联合免疫治疗具有更好的抗肿瘤活性。2023 年11月,BJC期刊上发表了一项研究(CS1003-101研究),该研究在实体瘤患者中探索了使用PD-1单抗nofazinlimab的疗效和安全性,并特别关注了nofazinlimab联合瑞戈非尼在mCRC患者中的试验结果13。
研究方法
CS1003-101研究是一项I期、开放标签、剂量递增和剂量扩展研究,于2018年5月至2021年5月在澳大利亚和新西兰开展。这项1期研究包括了nofazinlimab的剂量递增(1部分1a期:nofazinlimab Q3W,剂量水平按照1 mg/kg、3 mg/kg,200 mg固定剂量,10 mg/kg剂量递增)和剂量扩展(1部分1b期:nofazinlimab,1~3组200mg Q3W;4组200mg Q6W)。此外对瑞戈非尼剂量也进行了探索(2a部分),使用80或120 mg QD(第1-21天使用,每28天为一个周期)联合300 mg nofazinlimab(Q4W),以确定该方案的安全性、疗效和RP2D。
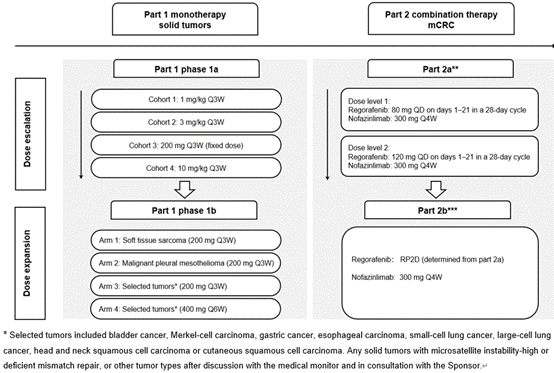
图1 研究设计
研究结果
疗效数据
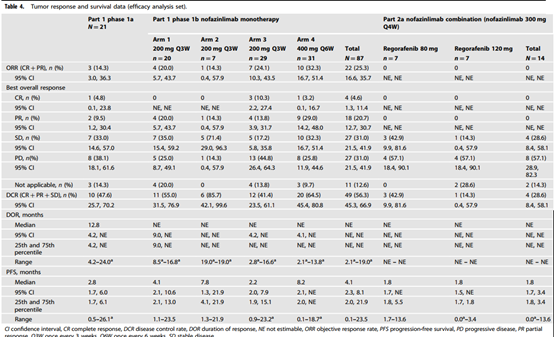
在1a期(N = 21)患者ORR为14.3%,DCR为47.6%,mPFS为2.8个月。
在1b期(N = 87),初步数据表明,200mg nofazinlimab Q3W和400mg Q6W的方案疗效基本一致。患者ORR为25.3%。DCR为56.3%,mPFS为4.1个月。
在2a期间(N = 14),未观察到客观缓解,DCR为56.3%,mPFS为1.8个月(表1)。
表1 1a、1b、2a期疗效数据
安全性数据
本研究显示最常见的治疗相关不良事件(AE)为疲劳。在1a期、1b期中, nofazinlimab治疗相关所有级别AE发生率分别为71.4%和14.3%,而nofazinlimab相关3/4级AE的发生率分别为5.7%和57.1%。nofazinlimab在1-10 mg/kg Q3W的剂量范围内均未发生剂量限制性毒性(DLT),最终确定200 mg Q3W为nofazinlimab单药治疗的RP2D。
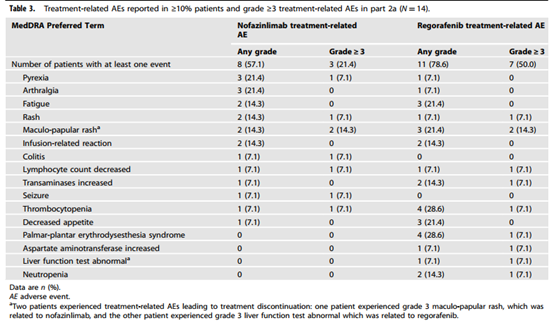
在2a期中,2例患者报告了DLT,nofazinlimab治疗相关所有级别AE和3/4级AE发生率分别为57.1%和21.4%,瑞戈非尼治疗相关所有级别AE和3/4级AE发生率分别为78.6%和50%(表2)。二者联用安全性良好。瑞戈非尼两种剂量(80mg、120mg)与Nofazinlimab 300mg Q4W均被确定为合理的RP2D。
表2 2a期安全性数据
研究结论
结果显示nofazinlimab单药的耐受性良好,在多种实体瘤中显示出初步抗肿瘤活性。瑞戈非尼联合nofazinlimab治疗mCRC安全性可控,但尚未发现肿瘤缓解。
专家锐评

该研究是nofazinlimab治疗晚期实体瘤的首次人体试验(CS1003-101)数据,nofazinlimab的疗效与安全性与其他免疫检查点抑制剂相当,多数治疗相关不良反应(TRAE)为1~2级,且易于管理。在1a、1b、2a期中,分别有9.5%、2.3%、7.1%的患者因TRAE而停用nofazinlimab。Nofazinlimab在实体瘤患者中也具有良好的抗肿瘤活性,在(CS1003-101)研究中,1a期和1b期的ORR分别为14.3和25.3%,抗肿瘤活性也与其他PD-L1/PD-1抑制剂相当。
REGONIVO研究开启了瑞戈非尼联合纳武利尤单抗治疗难治性微卫星稳定型(MSS)肠癌的先河14,其结果令大家看到了靶免联合的希望,此后多项研究相继开展。在CS1003-101研究2a期,进行了 nofazinlimab联合瑞戈非尼治疗mCRC的探索,结果显示,分别有21.4%和50%的患者经历了与nofazinlimab和瑞戈非尼治疗相关的3/4级不良反应,但大多数患者通过剂量调整和其他干预措施不良反应得以控制。瑞戈非尼80mg QD和120mg QD联合PD-1抑制剂nofazinlimab均被确定为合适的RP2D。而在REGONIVO研究中剂量递增的安全性分析中,瑞戈非尼160mg QD的剂量患者不能耐受(3例患者出现DLT)。
在CS1003-101研究2a期疗效分析中,纳入mCRC患者71.4%为MSS型,未观察到ORR缓解。而在REGONIVO研究中,瑞戈非尼联合纳武利尤单抗在MSS型mCRC患者中的ORR为33.3%。这两种截然不同的结果可能与种族差异有关,REGONIVO研究纳入患者均为日本患者,而在CS1003-101研究中纳入患者白人占大多数(78.6%~92%);另外,REGONIVO研究中mCRC的RAS突变率相对较低,为24%。但在CS1003-101研究中高达50%,已有研究证明,RAS突变与与免疫治疗应答存在负相关。总而言之,CS1003-101研究显示瑞戈非尼联合Nofazinlimab治疗在mCRC患者中具有良好的安全性,其有效性尚需要进一步确认。
在前期的基础研究中,瑞戈非尼已经被证实能够使血管正常化,同时可以改善肿瘤微环境,能够与免疫检查点抑制剂发挥更强的协同抗肿瘤效应。因此,瑞戈非尼与免疫治疗的联合方案在mCRC患者中被临床寄予厚望。期待未来进一步开展大规模临床研究,以提高这一部分人群的生存获益。
参考文献:
1. Strickler JH, et al. Tucatinib plus trastuzumab for chemotherapy-refractory, HER2-positive, RAS wild-type unresectable or metastatic colorectal cancer (MOUNTAINEER): a multicentre, open-label, phase 2 study. Lancet Oncol. 2023;24(5):496-508.
2. Strickler JH,et al. Impact of baseline molecular alterations on the efficacy of tucatinib (TUC) plus trastuzumab (Tras) for HER2+, RAS WT metastatic CRC (mCRC) in MOUNTAINEER. 2023 ESMO Abstract 551O.
3. 程怡,等. HER2变异结直肠癌临床研究进展. 实用肿瘤杂志. 2020;35(3):193-201.
4. Alan P. Venook,et al. Impact of primary tumor location on Overall Survival and Progression Free Survival in patients with metastatic colorectal cancer: Analysis of CALGB/SWOG 80405 (Alliance).ASCO 2016.
5. Heinemann, V., von Weikersthal, L.F., Decker, T. et al. FOLFIRI plus cetuximab or bevacizumab for advanced colorectal cancer: final survival and per-protocol analysis of FIRE-3, a randomised clinical trial. Br J Cancer (06 November 2020).
6. Nakamura Y, Taniguchi H, Ikeda M, et al. Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer: SCRUM-Japan GI-SCREEN and GOZILA studies. Nat Med. 2020 Dec;26(12):1859-1864.
7. Mazerd T, et al. Panitumumab (P) + FOLFIRINOX or mFOLFOX6 in unresectable metastatic colorectal cancer (mCRC) patients (pts) with RAS/BRAF wild-type (WT) tumor status from circulating DNA (cirDNA): First results of the randomised phase II PANIRINOX-UCGI28 study. 2023 ESMO abstract LBA30.
8. Bekaii-Saab TS,et al. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol. 2019;20(8):1070-1082.
9. Satoshi Yuki. The impacts of starting regorafenib dose on treatment outcomes in metastatic colorectal cancer. 2023 ESMO e-poster 615p.
10. Kato T, Kudo T, Kagawa Y, et al. Phase II dose titration study of regorafenib in progressive unresectable metastatic colorectal cancer. Sci Rep. 2023 Feb 9;13(1):2331.
11. Grothey A,et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013;381(9863):303-12.
12. 姜志超,孙永琨,张雯,等. 瑞戈非尼治疗晚期结直肠癌患者真实世界数据分析. 中华医学杂志.2020(26):2018-2022.
13. Day D,et al. A first-in-human phase 1 study of nofazinlimab, an anti-PD-1 antibody, in advanced solid tumors and in combination with regorafenib in metastatic colorectal cancer. Br J Cancer. 2023 Nov;129(10):1608-1618.
14. Fukuoka S et al. Regorafenib plus nivolumab in patients with advanced gastric or colorectal cancer: an open-label, dose-escalation, and dose-expansion phase Ib trial (REGONIVO, EPOC1603) J Clin Oncol. 2020;38:2053–61.
