GI 医声 第12期 I 靶向、免疫治疗全面开花,助力结直肠癌患者实现长生存
医脉通 2024.01.24

GI 医声
13条内容

导读:结直肠癌是全球最常见的三大癌症之一,在我国恶性肿瘤发病率中位居前列,也是癌症死亡的第二大原因,多数患者在确诊时已属于中晚期,约一半的患者会发生肝转移。目前,虽然化疗仍是晚期结直肠癌的主要治疗方式,但是随着靶向治疗和免疫治疗的加入,晚期结直肠癌的生存取得了突飞猛进的提升。本期GI医声特邀天津医科大学肿瘤医院空港医院赵鹏教授、南昌大学第一附属医院项晓军教授、四川大学华西医院马骥教授分享结直肠癌治疗进展,以飨读者。

研究背景
微卫星稳定型(MSS)结直肠癌(CRC)被称为“冷肿瘤”,因为其对程序性死亡受体-1(PD-1)单抗几乎没有反应。最近的一项REGONIVO研究表明,瑞戈非尼联合纳武利尤单抗治疗MSS型转移性CRC(mCRC)具有令人鼓舞的疗效。然而,只有一小部分患者可能从联合治疗中获益。本研究1旨在评估免疫检查点抑制剂(ICI)联合瑞戈非尼治疗难治性MSS型mCRC的疗效和安全性,并发现能够有效地对获益人群进行分层的生物标志物。
研究设计
本研究对2018年11月到2023年4月在新华医院接受瑞戈非尼联合PD-1单抗治疗的MSS型mCRC患者进行了回顾性分析,纳入患者为在标准治疗(包括氟尿嘧啶、奥沙利铂和亚叶酸钙[FOLFOX]和氟尿嘧啶、伊立替康和亚叶酸钙[FOLFIRI])后出现疾病进展的MSS型mCRC患者接受瑞戈非尼联合PD-1单抗作为三线或三线以上治疗,同时也纳入了既往暴露于瑞戈非尼单药治疗的患者。PD-1单抗包括纳武利尤单抗、特瑞普利单抗、斯鲁利单抗和信迪利单抗。回顾并评估了客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、基因突变状态和治疗相关不良事件(TRAE)的发生率。
研究结果
疗效评价
本研究共纳入21例MSS型mCRC患者,中位治疗时间为4个月。总人群中,ORR和DCR分别为19%(4/21例)和28.5%(6/21例)。3例患者在分析时正处于部分缓解(PR)状态中,包括1例达到完全缓解(CR)且已持续28个月的患者,另外还有2例患者(9.5%)维持疾病稳定(SD)。所有21例患者均可评价PFS和OS,中位PFS为4个月(95CI:3.3-4.6),中位OS为25个月(95CI:13.3-36.6)。
表1. 21例患者的疗效评价
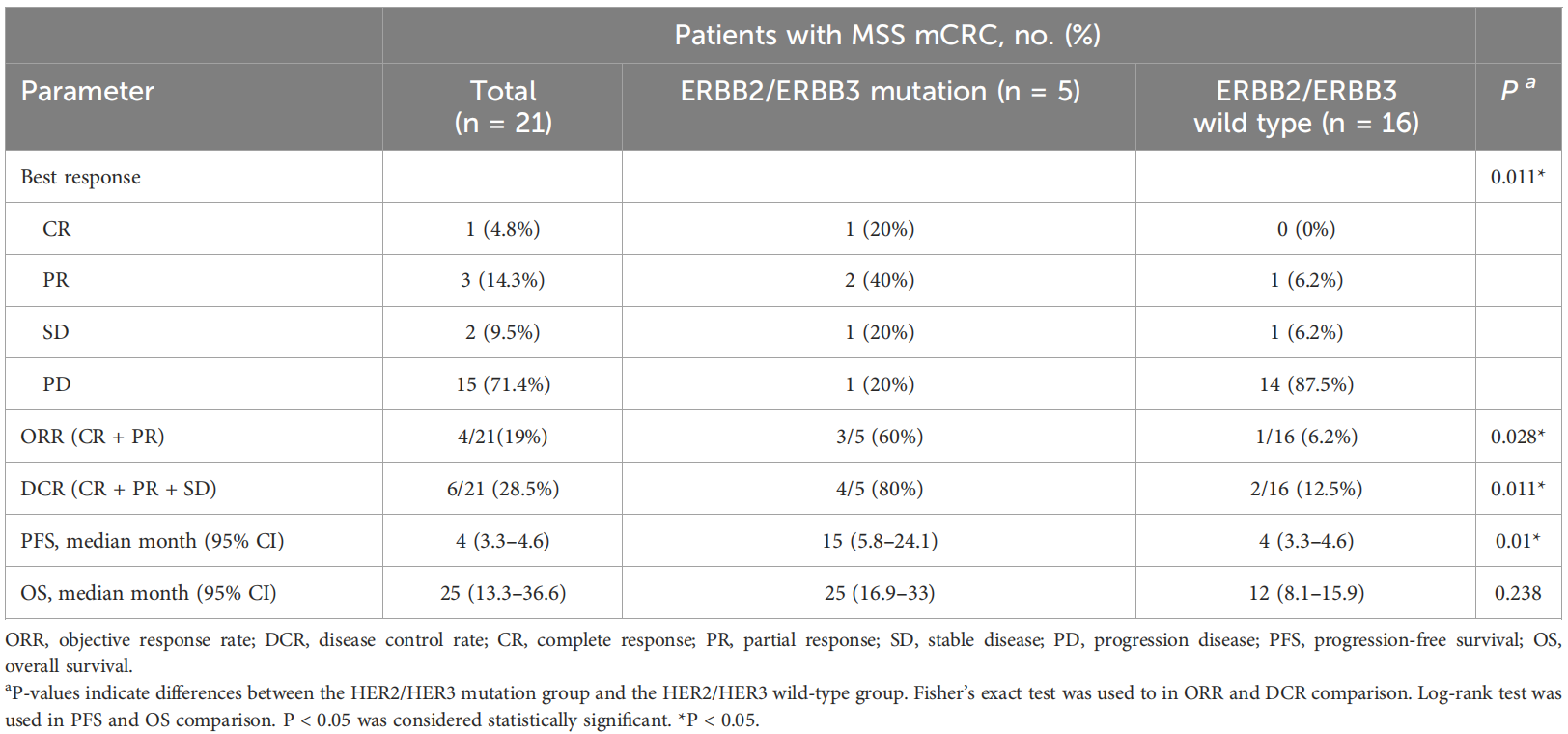
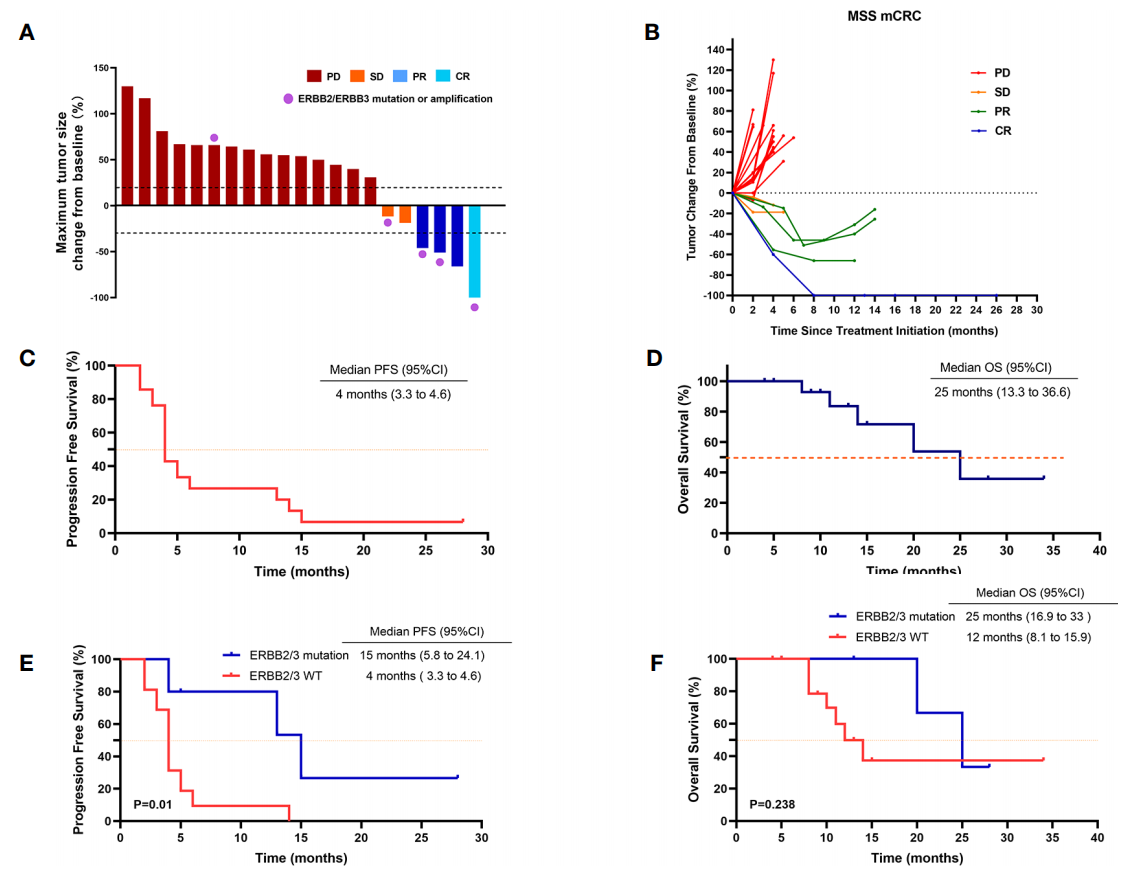
图1. 21例患者的肿瘤缓解情况
单因素分析
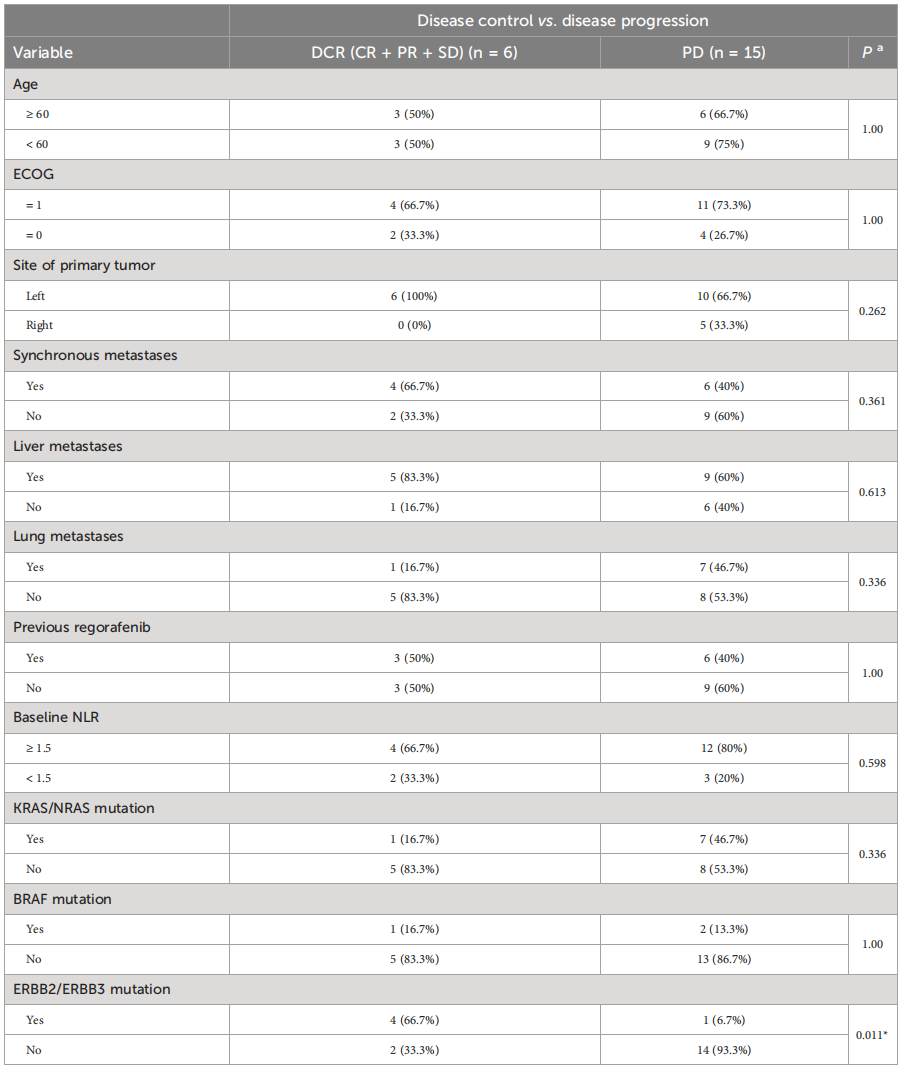
单因素分析显示,只有ERBB2/ERBB3突变被证实为一个潜在的预测因素,并与疾病控制风险增加相关(OR=28;95CI:1.9-394.4;p=0.014)。校正ECOG PS、RAS突变状态、BRAF突变状态和肝转移后,ERBB2/ERBB3突变的疾病控制风险增加仍然显著(校正后比值比[aOR]=54.8;95%CI:1.2-2497.3;p=0.04)。
表2. 疾病进展和疾病控制的风险因素分析
此外,ERBB2/ERBB3突变患者的ORR和DCR(分别为60%和80%)显著高于野生型患者(分别为6.2%和12.5%),中位PFS也具有明显优势(15个月 vs 4个月,p=0.01),但两组之间的OS无显著差异(p=0.238)。
安全性
联合治疗组耐受性良好,治疗期间未发现≥4级不良反应。21例患者中,1-2级TRAE的发生率为76%,3级TRAE发生率为14.3%。最常见的1-2级治疗期间不良事件(TRAE)为高血压(28.5)、食欲下降(28.5%)、疲乏(19%)、腹泻(19%)、转氨酶升高(19%)和手足皮肤反应(14.2%)。
结论
瑞戈非尼联合PD-1单抗为难治性MSS型mCRC患者提供了一种可耐受的可行治疗方案。ERBB2/ERBB3突变患者可能是该联合治疗方案的首选人群。
专家锐评

MSS型CRC以低肿瘤突变负荷和和缺乏免疫细胞浸润为特征,由于对免疫治疗几乎无反应,被称为“冷肿瘤”。目前诸多研究正在积极探索如何将联合治疗作为使MSS型“冷肿瘤”转化为对免疫治疗有效的“热肿瘤”的一种手段的可行性。尽管部分临床研究已经将ICI与其他治疗手段进行联合应用,但这些研究并未显示出该联合治疗方案在ORR、PFS或OS上的显著获益。
免疫抑制细胞,包括调节性T细胞(Tregs)和肿瘤相关巨噬细胞(TAMs),存在于MSS型CRC患者的肿瘤微环境内,这些细胞可以有效抑制T细胞的活性。临床前研究证明,多激酶抑制剂瑞戈非尼可通过抑制集落刺激因子1受体(CSF1R)和血管内皮生长因子受体(VEGFR)缓解Tregs和TAMs对T细胞的免疫抑制作用,这一机制可用于克服MSS型CRC对于ICI的耐药性。
因此,本研究评估了瑞戈非尼联合PD-1抗体作为三线及以上治疗21例难治性MSS型mCRC患者的疗效。总的来说,该联合治疗方案对于这部分患者表现出了一定程度的治疗效果,总体ORR达到了19%,中位PFS和OS分别达到4个月和25个月。由此可见,本研究中的联合治疗方案可能是难治性MSS型mCRC患者的一种可行的治疗选择。
尽管联合治疗的效果令人鼓舞,但仍有部分患者出现疾病进展,因此进一步探索能筛选获益人群的生物标志物是至关重要的。DCR预测因素的亚组分析显示,该联合方案的临床获益与ERBB2/ERBB3的突变状态相关,ERBB2/ERBB3突变患者的ORR(60% vs 6.2%,p=0.028)、中位PFS(15个月 vs 4个月,p=0.01)都明显优于野生型,且唯一的CR患者同时存在ERBB3 G284R突变和ERBB3扩增。表明ERBB2/ERBB3突变患者可能是该联合治疗方案的首选人群。

研究背景
2023年8月,国际知名医学期刊nature medicine在线发表了一项单臂、1b/2期临床试验2。研究的首要终点是评估度伐利尤单抗+曲美木单抗联合mFOLFOX6方案一线治疗RAS突变的不可切除转移性结直肠癌患者的安全性及微卫星稳定(MSS)肠癌人群中的疗效(3个月的无疾病进展生存期,3m-PFS),次要终点为评估该方案治疗微卫星稳定(MSS)型患者的有效率(ORR)及总生存期(OS)。
研究设计
2017 年 8 月 30 日至 2019 年 12 月 20 日期间,研究入组了57例患者,接受为期3个月的mFOLFOX6化疗(共6个疗程),并联合度伐利尤单抗和曲美木单抗治疗。经联合治疗后病情稳定或肿瘤退缩的患者,继续接受度伐利尤单抗维持治疗,直至疾病进展或最多1年。
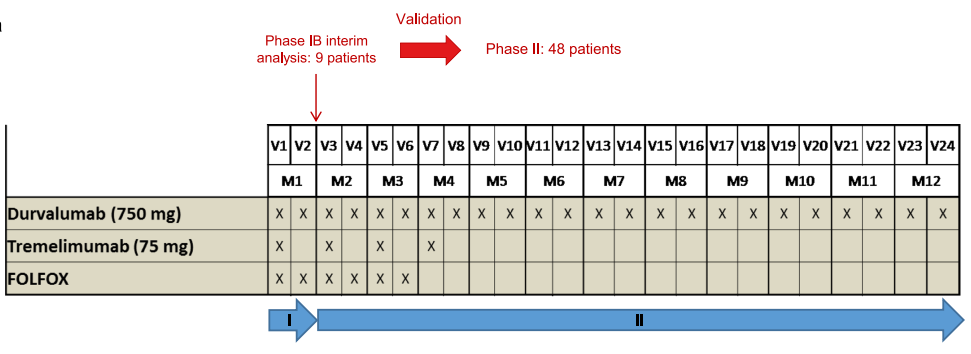
图1 研究设计
研究结果
57例RAS突变的不可切除转移性结直肠癌患者一线接受了mFOLFOX6+度伐利尤单抗+曲美木单抗的联合治疗。在其中48例的MSS型肠癌患者中,达到了研究主要观察终点,即3个月PSF率为90.7%。此外,6个月、12个月、24个月PFS率分别为60.4%、26.9%、6.7%,中位PFS为8.2个月(95% CI:5.9–8.6月);6个月、12个月、24个月的OS率分别为95.8%、81.1%及57.6%,中位OS尚未达到。MSS患者的ORR为64.5%,其中52%的患者达到部分缓解(PR),12.5%的患者达到完全缓解(CR)。疾病控制率(DCR)为93.7%。
在57例整体人群中,6个月、12个月和24个月OS率分别为96.5%、80.6%、59.1%;6个月、12个月和24个月的PFS率为63.2%、38.5%和19.9%。中位DOR为8.5个月,28%的患者在12个月时仍接受度伐利尤单抗治疗。截止至数据分析时,2例患者仍在接受治疗;34例患者因疾病进展出组;13例患者因其他原因停止治疗,并出现复发;8例患者仍处于完全缓解,无复发。
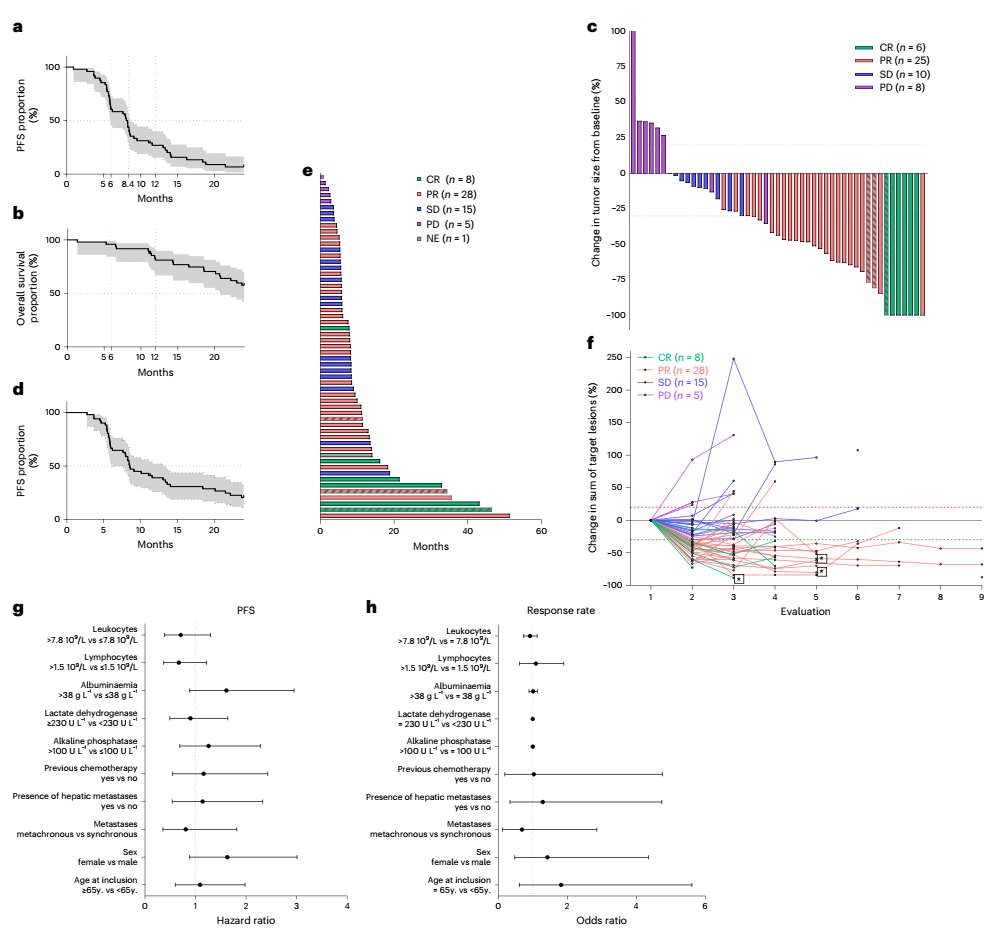
图2 疗效分析结果
安全性方面,研究中观察到的毒性主要与化疗有关,最常见的不良反应事件是腹泻、中性粒细胞减少和血小板减少。对于与免疫疗法相关的毒性,最常见的是皮肤反应、内分泌异常、结肠炎和肝炎。
转录组相关的探索性分析发现,基线时T细胞浸润与较长的PFS之间存在相关性。在免疫细胞、T细胞趋化剂趋化因子和低基质信号中富集的TME是对化疗与免疫治疗有更好反应的预测因素。对T细胞对端粒酶和NY-ESO-1反应联合分析显示,在C2或C5处至少存在一种反应性,与更长的PFS显著相关,基线免疫浸润的存在和针对共同肿瘤抗原的免疫反应的诱导与对治疗的反应相关。
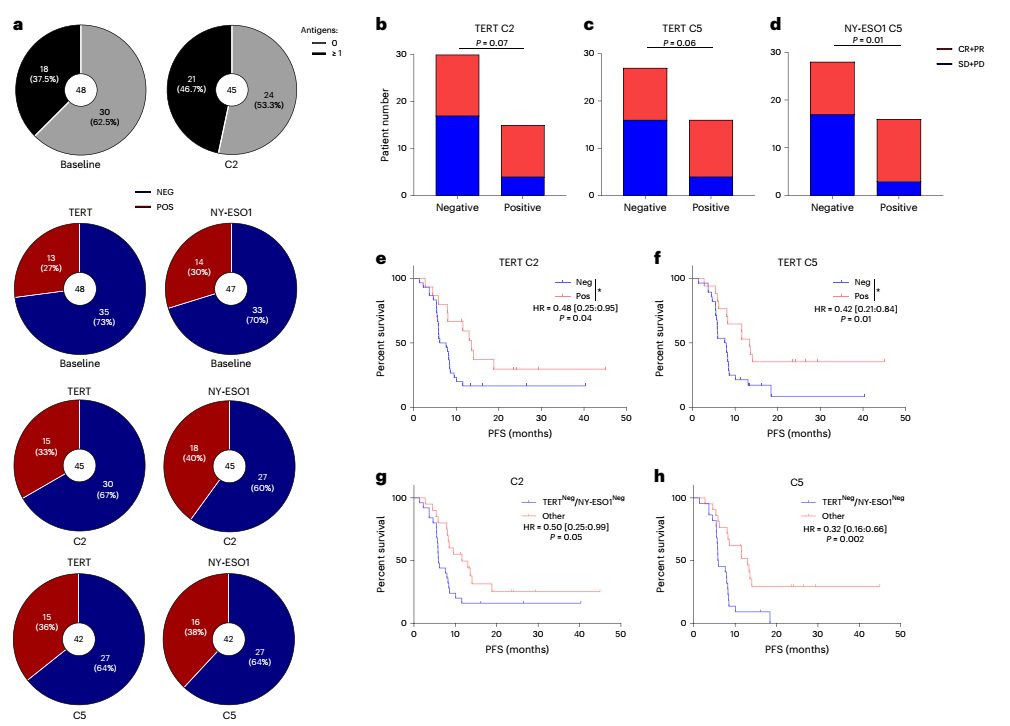
图3 免疫学相关的探索性分析结果
研究结论
该研究报道了双免药物+化疗一线治疗不可切除的MSS型转移性结直肠癌患者,取得良好临床疗效;并通过深入的分子和免疫分析,为更好地选择哪些MSS型转移性结直肠癌患者进行化疗联合免疫治疗提供了线索,具有重要的临床意义。
专家锐评

转移性结直肠癌是一种异质性疾病,不同特征的结直肠癌患者需要不同的治疗手段,以获得更好的预后。现阶段,针对微卫星不稳定性(MSI)的肿瘤患者,使用免疫检查点抑制剂进行免疫治疗已显示出较好疗效。然而,对于MSS型结直肠癌患者,单用免疫治疗往往无效。临床前数据表明,将免疫检查点抑制剂与免疫原性细胞死亡诱导剂,如奥沙利铂联合使用,可以提高免疫治疗的疗效。本研究报道了化疗联合双免一线治疗RAS突变型转移性结直肠癌患者的安全性及疗效。研究达到了主要终点,即在MSS人群中,3个月PFS达到90.7%。此外,该研究的次要终点ORR达64.5%,是迄今为止相关报道较好的ORR之一。
众所周知,肝转移是免疫治疗的不利因素。CD3和CD8 T细胞在CRC浸润边缘和肝转移中的积累与预后相关。肿瘤部位的CTLA-4表达与更好的反应相关。与单独抗PD-1/PD-L1相比,联合抗CTLA-4治疗疗效更佳。另外,对基线免疫浸润和成纤维细胞反应的分析在预测化疗免疫治疗的疗效方面可能很重要。化疗+免疫治疗可以促进针对MSS型转移性结直肠癌中共享的肿瘤抗原和新抗原的免疫应答,并且这种免疫应答与治疗疗效相关。
综上所述,度伐利尤单抗+曲美木单抗联合化疗在MSS型转移性结直肠癌患者中显示出了良好的耐受性和疗效。这项试验的数据进一步支持了免疫疗法联合化疗治疗MSS型结直肠癌患者具有较好的应用前景,对于已经失去手术机会的患者,该方案一线治疗有望获得较好疗效。期待未来开展更大样本量的研究及更多相关数据的披露。

研究背景
肝脏是结直肠癌(CRC)血行转移最主要的靶器官,CRC肝转移(CRLM)是晚期CRC治疗的重难点之一。近一半的患者确诊时或CRC原发灶根治术后发生肝转移,其中绝大多数(80%~90%)的肝转移灶初始无法获得根治性切除。初始不可切除的CRLM患者在通过全身诱导治疗缩小肿瘤体积后,有可能达到根治性局部治疗的标准,但对于这部分患者的最佳全身诱导方案尚未达成共识。CAIRO5研究旨在找到最佳的全身诱导方案,将最初不可切除的 CRLM 转化为可手术切除。CAIRO5研究PFS结果曾于2023年6月发表于国际顶尖期刊Lancet Oncology3。2023年ESMO大会进一步公布了该研究的OS更新数据4。
研究方法
右半和或RAS/BRAFV600E突变型初始不可切除CRLM患者被随机1:1分配至FOLFOX/FOLFIRI联合贝伐珠单抗(A组)或FOLFOXIRI联合贝伐珠单抗(B组);左半且RAS/BRAFV600E野生型初始不可切除CRLM患者被随机1:1分配至接受FOLFOX/FOLFIRI联合贝伐珠单抗(C组)或FOLFOX/FOLFIRI联合帕尼单抗(D组)。外科和影像学专家组在基线及之后每2个月评估可切除性。基于CRLM灶的可切除性(潜在可切除vs.永久不可切除)、血清乳酸脱氢酶浓度(根据该中心的临界值正常vs.异常水平)、化疗方案的选择(伊立替康vs.奥沙利铂)、BRAFV600E突变状态(野生型vs.突变型;仅适用于A组和B组)等因素进行分层。总生存(OS,次要终点)使用分层log-rank检验进行对比,风险比(HR)使用Cox比例风险回归模型计算。
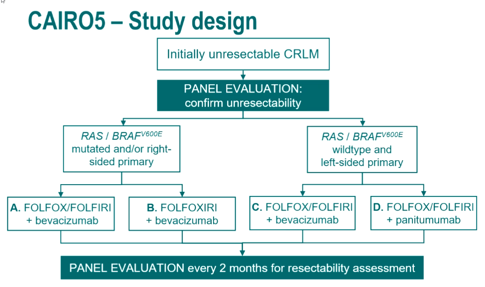
图1 CAIRO5研究设计
研究结果
2014年11月~2022年1月,CAIRO5研究纳入47个中心530例患者,排除9例不符合要求患者后,A/B/C/D组分别是147/144/114/116例。中位随访57个月。患者基线特征如图2。

图2 CAIRO5研究患者基线特征
A组、B组OS数据
A组和B组中位OS分别是23.6个月 vs 24.1个月(HR 0.92, 95% CI 0.70-1.20, p=0.52)。
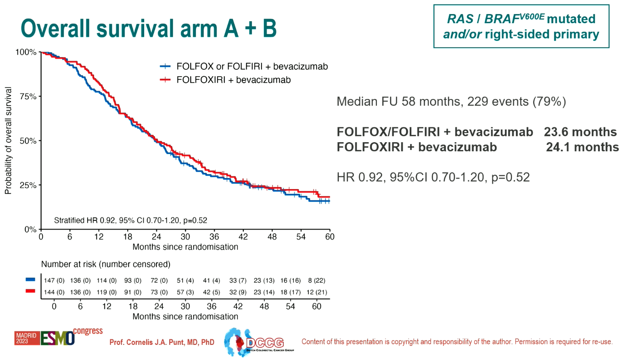
图2 A组和B组OS
A组和B组接受局部治疗的患者中位OS显著优于不接受者(A组:39.3个月 vs 15.6个月;HR=0.27; p<0.001。B组:36.0个月 vs 16.1个月;HR=0.30;p<0.001)。
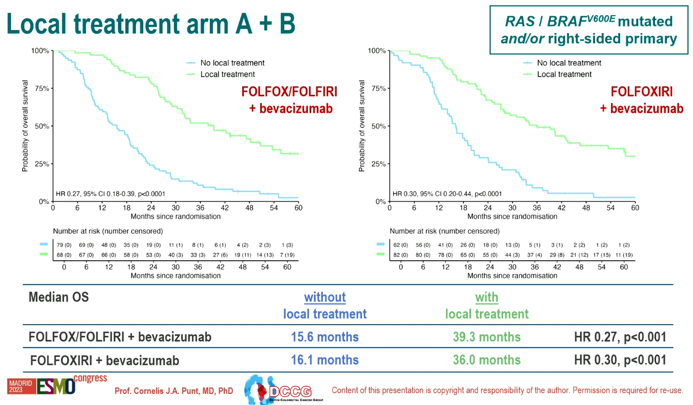
图3 A组和B组局部治疗 vs 非局部治疗OS
C组、D组OS数据
C组和D组的中位OS分别是40.4个月 vs 38.3个月(HR 1.02, 95% CI 0.72-1.46, p=0.89)。
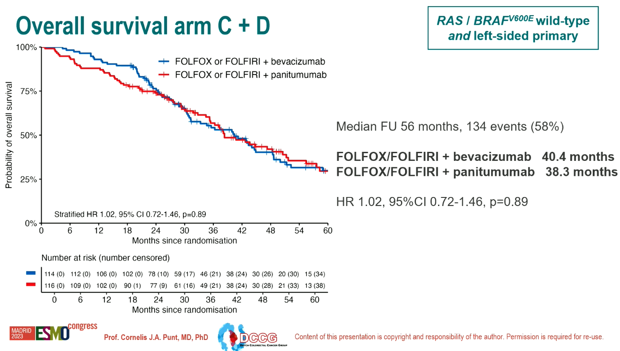
图4 C组和D组OS
C组和D组接受局部治疗的患者中位OS显著优于不接受者(C组:48.7个月 vs 25.3个月;HR=0.22; p<0.001。D组:57.6个月 vs 16.1个月;HR=0.19;p<0.001)
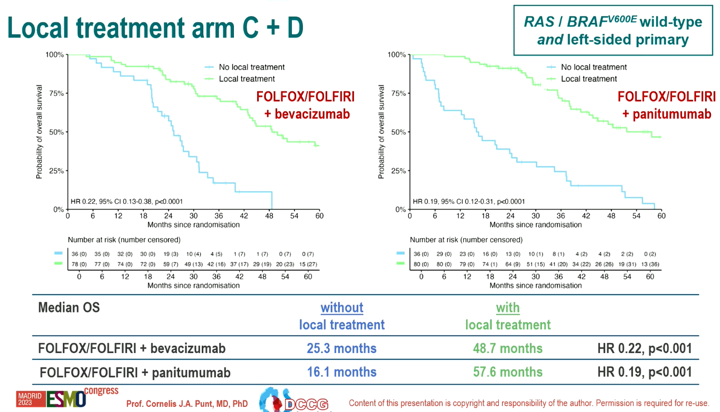
图3 C组和D组局部治疗 vs 非局部治疗OS
A组、B组、C组、D组6个月复发率
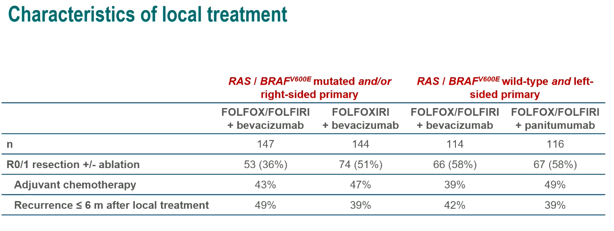
A组和B组分别有49%和39%患者完成局部治疗后6个月内复发(p=0.28),C组和D组分别是42%和39%患者完成局部治疗后6个月内复发(p=0.73)。
研究结论
对于初始不可切除CRLM患者,FOLFOXIRI+贝伐珠单抗和FOLFOX/FOLFIRI+贝伐珠单抗治疗右半和/或RAS/BRAFV600E突变肿瘤的OS无显著差异,左半及RAS/BRAFV600E野生型肿瘤接受FOLFOX/FOLFIRI联合帕尼单抗 vs 贝伐珠单抗OS也没有显著差异。接受局部治疗的患者较没有接受的患者显著获益。
专家锐评

针对初始不可切除的CRLM,部分前瞻性研究提示,11%-57%的患者在诱导全身治疗后肿瘤可能会转化为可切除状态,但既往研究未对具体的诱导治疗方案进行评估。CAIRO5试验是首个探索CRLM患者诱导全身治疗最佳方案的前瞻性III期随机研究,CAIRO5研究既往数据显示,对于右半结肠肿瘤或RAS/BRAFV600E突变型CRLM患者,与FOLFOX/FOLFIRI+贝伐珠单抗相比,FOLFOXIRI+贝伐珠单抗可显著改善患者的PFS、ORR和局部治疗率3。本次2023 ESMO更新的OS数据显示,这两种治疗方案对患者的OS无影响4。该研究的主要终点是PFS,因此研究者建议将该方案作为此类患者诱导全身治疗的首选方案。
对于左半结肠肿瘤且RAS/BRAFV600E野生型CRLM患者,化疗联合帕尼单抗相较于化疗联合贝伐珠单抗可改善患者的ORR,但这一改善并未转化为局部治疗和PFS的获益3。本次2023 ESMO更新的OS数据显示,两种治疗方案中患者的OS亦无显著差异4。提示抗EGFR单抗与抗VEGF单抗联合化疗治疗左半结肠肿瘤且RAS/BRAFV600E野生型CRLM生存获益相当。但未来仍需要进一步的研究证实。
值得注意的是,CAIRO5研究纳入患者为单纯肝转移患者,并前瞻性考虑了RAS/BRAFV600E突变状态以及原发性肿瘤的部位。在未有专家共识的前提下为初始无法切除的CRLM患者提供了临床指导。对于肺转移的mCRC来说肿瘤的生物学行为和预后与CRLM患者有很大的不同,因此有必要在肺转移的患者中探索最优的治疗策略,以期对于mCRC根据转移部位的不同制定个体化的治疗策略。
参考文献
1.Dai X, et al. Refractory microsatellite stable metastatic colorectal cancer with ERBB2/ERBB3 mutation may be preferred population for regorafenib plus PD-1 inhibitor therapy: a real-world study. Front Oncol. 2023 Aug 23;13:1227644.
2.Thibaudin M, et al. First-line durvalumab and tremelimumab with chemotherapy in RAS-mutated metastatic colorectal cancer: a phase 1b/2 trial. Nat Med. 2023 Aug;29(8):2087-2098.
3.Bond MJG,et al. First-line systemic treatment strategies in patients with initially unresectable colorectal cancer liver metastases (CAIRO5): an open-label, multicentre, randomised, controlled, phase 3 study from the Dutch Colorectal Cancer Group. Lancet Oncol. 2023;24(7):757-771.
4.Punt CJA,et al. First-line systemic treatment in patients with initially unresectable colorectal cancer liver metastases (CRLM): Overall survival of the phase III CAIRO5 study of the Dutch Colorectal Cancer Group. 2023 ESMO LBA27.
